
【题目】(一)铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表中第___族,其基态原子中未成对电子的个数为_________。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________,尿素分子中C、N原子的杂化方式分别是_____、___,其分子中σ键与π键的数目之比为___,所含非金属元素的电负性由大到小的顺序是_______。
(二)已知元素镓和砷的单质及其化合物在工业生产上有重要的用途。回答下列问题:
(1)砷元素基态原子的电子排布式为_____________。
(2)砷与氢元素。可形成化合物砷化氢,该化合物的空间构型为_____,其中砷原子的杂化方式为__________。
(3)根据等电子原理,写出由短周期元素组成且与砷化氢互为等电子体的一种离子的化学式__________。
【答案】 VIII 3 [Ar]3d5(或1s2s2p63s3p63d5) sp2 sp3 7:1 O>N>C>H ls22s22p63s23p63d104s24p3 三角锥型 sp3 H3O+
【解析】(一)考查洪特规则、电子排布式的书写、杂化类型的判断、化学键的数目、电负性的规律(1)Co位于第四周期VIII族,27号元素,基态原子钴电子排布式为[Ar]3d74s2,根据洪特规则,未成对电子数为3;(2)基态铁原子的电子排布式为[Ar]3d64s2,即Fe3+的电子排布式为[Ar]3d5或1s2s2p63s3p63d5;尿素的结构简式为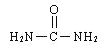 ,C有3个σ键,无孤电子对,因此C的杂化类型为sp2,N原子全部都是单键,杂化类型为sp3,成键原子之间只能形成一个σ键,双键有一个π键,因此σ键与π键的数目之比为7:1;同周期从左向右电负性增大,即电负性大小顺序是O>N>C>H;(二)考查空间构型、等电子体,(1)As位于第四周期VA,即基态砷原子的电子排布式为ls22s22p63s23p63d104s24p3;(2)砷化氢的分子式为AsH3,中心原子As有3个σ键,孤电子对数为(5-3×1)/2=1,杂化类型为sp3,空间构型为三角锥形;(3)根据等电子体的定义,与AsH3等电子体的分子,其中一种为NH3,推出与AsH3互为等电子体的离子可能是H3O+、CH3+等。
,C有3个σ键,无孤电子对,因此C的杂化类型为sp2,N原子全部都是单键,杂化类型为sp3,成键原子之间只能形成一个σ键,双键有一个π键,因此σ键与π键的数目之比为7:1;同周期从左向右电负性增大,即电负性大小顺序是O>N>C>H;(二)考查空间构型、等电子体,(1)As位于第四周期VA,即基态砷原子的电子排布式为ls22s22p63s23p63d104s24p3;(2)砷化氢的分子式为AsH3,中心原子As有3个σ键,孤电子对数为(5-3×1)/2=1,杂化类型为sp3,空间构型为三角锥形;(3)根据等电子体的定义,与AsH3等电子体的分子,其中一种为NH3,推出与AsH3互为等电子体的离子可能是H3O+、CH3+等。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】阿司匹林的化学成分是乙酰水杨酸,在胃内分解成水杨酸。若服用阿司匹林过量时可出现头痛、眩晕、恶心、呕吐、耳鸣,甚至精神错乱等副作用,称之为水杨酸反应。若出现水杨酸反应,应该采取的措施是
A. 饮用大量清水 B. 洗胃 C. 减少用药量 D. 停药,静脉滴注NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,33.6L 氟化氢中含有氟原子的数目为 1.5NA
B. 常温常压下,7.0g 乙烯与丙烯的混合物中含有氢原子的数目为 NA
C. 50mL l8.4mol/L 浓硫酸与足量铜微热反应,生成 SO2 分子的数目为 0.46NA
D. 某密闭容器盛有 0.lmolN2 和 0.3molH2,在一定条件下充分反应,转移电子的数目为 0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
A.常温常压下,44gCO2中含有的氧原子数目为2NA
B.标准状况下,22.4LH2O含有的分子数目为NA
C.1molL﹣1K2SO4溶液中含有的钾离子数目为2NA
D.1molFe在足量的Cl2中完全燃烧,转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,将a g NH3完全溶于水,得到V mL溶液,设该溶液的密度为ρ g·cm-3,质量分数为ω,其中含N的物质的量为b mol。下列叙述中不正确的是
A. 溶质的质量分数ω=![]() ×100%
×100%
B. 溶质的物质的量浓度c= 1000a/17Vmol·L-1
C. 溶液中c(OH-)= 1000b/Vmol·L-1+c(H+)
D. 上述溶液中再加入V mL水后,所得溶液中溶质的质量分数小于0.5ω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是( )
A.过渡元素全部都是副族元素
B.短周期共有32 种元素
C.科学研究时,经常在过渡元素中寻找耐高温、耐腐蚀的合金材料
D.元素周期表共七个横行代表七个周期,18 个纵横代表18 个族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”ke牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1 000 mL、密度1.192 g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中________L的CO2(标准状况)而变质。(已知:CO2+NaClO+H2O=NaHCO3+HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25%NaClO的消毒液。下列说法正确的是________。
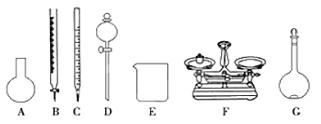
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)当H2O和H2O2分子个数比为1:1 时,原子总数之比为_____________,电子数之比为________________。
(2)V mLAl2(SO4)3溶液中含a gAl3+,取出V/4 mL溶液稀释成V mL后,SO42-的物质的量浓度为______________(用含a、V的代数式表示,化简到最简整数比)。
(3)在一定条件下,11.2 g单质R与0.3 molCl2完全反应,生成0.2 molRClx,则x=______,RClx 的摩尔质量为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com