
| A. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]沉淀,观察铁钉周围出现蓝色沉淀的快慢 | |
| B. | 探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| C. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(试纸)为:中和滴定实验、pH试纸 | |
| D. | 从海带中提取碘,可将灰化后的海带加入水中煮沸一段时间后过滤,向滤液中滴入几滴硫酸,再加入适量H2O2溶液氧化,最后加入CCl4萃取分离 |
分析 A.亚铁离子和铁氰化钾溶液反应生成蓝色沉淀;
B.控制其他量相同,只控制温度不同;
C.确定醋酸的电离常数,根据CH3COOH?CH3COO-+H+,应分别确定CH3COOH的物质的量浓度和H+的物质的量浓度,可用滴定法确定CH3COOH的物质的量浓度,用pH试纸可粗略确定H+的物质的量浓度;
D.海带中含有碘离子,在酸性环境中过氧化氢能够氧化碘离子,碘单质易溶于有机溶剂.
解答 解:A.去锈的绕有细铜丝的铁钉在盐酸溶液中形成原电池,产生亚铁离子速度快,与铁氰化钾溶液反应生成蓝色沉淀所用的时间短,故A正确;
B.探究温度对反应速率的影响时,控制其他量相同,只控制温度不同,则应将混合物分别在热水、冷水中反应,故B错误;
C.可用滴定法确定CH3COOH的物质的量浓度,用pH试纸可粗略确定H+的物质的量浓度,进而计算电离常数,故C正确;
D.海带中含有碘离子,在酸性环境中过氧化氢能够氧化碘离子,碘单质易溶于CCl4,最后加入CCl4萃取分离,故D正确;
故选B.
点评 本题考查了物质性质和离子检验的实验操作,为高频考点,把握物质的性质及反应原理为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
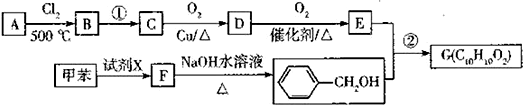
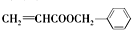 .
.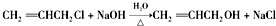 .
.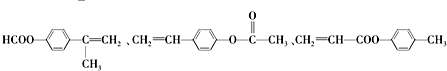 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 盐酸的浓度 | 反应温度 | 铝片消失的时间 |
| ① | 0.1mol/L | 20℃ | 400s |
| ② | 0.2mol/L | 20℃ | 200s |
| ③ | 0.2mol/L | 30℃ | 50s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素元素原子最外层电子数都是7 | B. | 从氟到碘,卤素原子半径依次减小 | ||
| C. | 卤素元素单质均为气态 | D. | 从氟到碘,非金属性逐渐增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com