
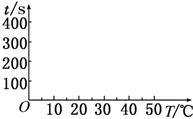
 在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
在锌与盐酸反应的实验中,某同学得到的结果如下表所示:| 锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | t1 |
| E | 2 | 颗粒 | 15 | t2 |
| F | 2 | 粉末 | 15 | t3 |
| G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
分析 (1)Zn与盐酸反应生成氯化锌和氢气,放出热量;
(2)由A、B、C、D中的实验可知,温度每升高10℃时,时间减少一半;
(3)由数据可知,温度高,反应速率大;
(4)D与G相比较,G中构成原电池,反应速率快;
E与F相比较,接触面积大的反应速率快.
解答 解:(1)Zn与盐酸反应生成氯化锌和氢气,离子反应为Zn+2H+═Zn2++H2↑,放出热量,为放热反应,故答案为:Zn+2H+═Zn2++H2↑; 放热;
(2)由A、B、C、D中的实验可知,温度每升高10℃时,时间减少一半,则t1=100s×$\frac{1}{2}$=50s,时间对温度的曲线图为 ,
,
故答案为:50; ;
;
(3)该反应中温度影响反应速率的规律是温度每升高10℃,反应速率加快到原来的2倍,故答案为:温度每升高10℃,反应速率加快到原来的2倍;
(4)G组中可形成Cu-Zn原电池,发生原电池反应,反应速率加快,则t1>t4;F组中锌为粉末状,表面积较大,反应速率较快,则t2>t3,
故答案为:>;G组中可形成Cu-Zn原电池,发生原电池反应,反应速率加快;>;F组中锌为粉末状,表面积较大,反应速率较快.
点评 本题考查化学反应速率的影响因素,为高频考点,把握常见的影响速率的因素及控制变量法实验为解答的关键,侧重分析与应用能力的考查,注重迁移应用能力的训练,题目难度不大.


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若电解质溶液为KOH溶液,则电池工作一段时间后pH有明显变化 | |
| B. | Zn作负极,被氧化 | |
| C. | Ag2O在正极上发生还原反应 | |
| D. | 电解质溶液中的阴离子移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①②③⑤ | B. | ①②③④⑤ | C. | 仅②③④⑥ | D. | 仅①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
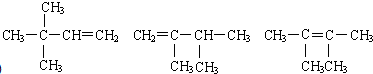 任意一种(写出其中一种即可).
任意一种(写出其中一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
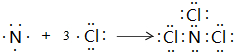 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com