
下列排列顺序不正确的是
| A.热稳定性:CH4> SiH4 >HF | B.原子半径:Na>Mg>O |
| C.酸性:HClO4>H2SO4>H3PO4 | D.非金属性:F>Cl>Br |
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:单选题
下列有关原子结构和元素周期律的表述,正确的是( )
①原子序数为16的元素的最高化合价为+4
②IA族元素是同周期中失电子能力最强的元素
③第2周期IVA族元素的原子核电荷数和中子数一定为6
④原子序数为13的元素位于元素周期表的第3周期III族
| A.①② | B.①③ | C.②④ | D.③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列排列顺序正确的是( )
① 热稳定性:H2O>HF>H2S ② 原子半径:Na>Mg>O
③ 酸性:H3PO4>H2SO4>HClO4 ④ 熔沸点:H2O>HF>HCl
| A.①③ | B.②④ | C.①④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
1898年,IUPAC(International Union of Pure and Applied Chemistry,国际纯粹与应用化学联合会)建议用1~18列代替原周期表中主族、副族序号,请问原第IVA族应该在第几列?
| A.第4列 | B.第14列 |
| C.第5列 | D.第15列 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
| A | | C |
| | B | |
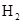 反应的化学方
反应的化学方 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期中电负性最大的。请回答:
(1)A原子的核外电子排布的轨道表示式________,B原子的核外电子排布式__________________,C原子的价电子排布式________。
(2)A、B、C的气态氢化物中最不稳定的是________(填化学式)。
(3) A、B、C的最高价氧化物的水化物中,酸性最强的是________。
(4)AC4的结构式为________,中心原子A的杂化方式________杂化,是________(填“极性”或“非极性”)分子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com