
| A. | 苯、己烷 | B. | 己炔、己烯 | C. | 苯、甲苯 | D. | 己烯、苯 |
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子的还原性强弱:I->Fe2+>Br- | |
| B. | 当a≥b时,发生的离子反应:2I-+Br2=I2++2Br- | |
| C. | 当3a≤2b时,发生的离子反应:2Fe2++2I-+2Br2=2Fe3++I2+4Br- | |
| D. | 当5a=4b时,反应后的离子浓度之比:c(Fe2+):c(Fe3+):c(Br-)=1:1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是用来描述微观粒子的物理量 | |
| B. | 1 mol任何物质都含有Na个原子 | |
| C. | 0.5 mol H2O中含有的原子数目为1.5Na | |
| D. | 64g氧相当于2mol氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H218O 的摩尔质量为20g?mol-1 | |
| B. | 铁粉溶于盐酸的化学方程式:2Fe+6HCl=2FeCl3+3H2↑ | |
| C. | 氯离子的结构示意图: | |
| D. | 乙醇的分子式为CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色食品是不含任何化学物质的食品 | |
| B. | 加碘食盐中所加的“碘”一般是碘化钾或碘单质 | |
| C. | 区别氯化铁溶液和氢氧化铁胶体可以用丁达尔效应 | |
| D. | 用干燥的有色布条可以检验氯化氢气体中是否混有氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
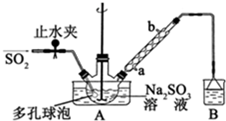
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com