

| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
| ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。 ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
 Fe(SCN)3 平衡逆向移动而褪色。
Fe(SCN)3 平衡逆向移动而褪色。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源:不详 题型:填空题

| A.饱和食盐水 | B.Na2SO4溶液 |
| C.NaOH溶液 | D.浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
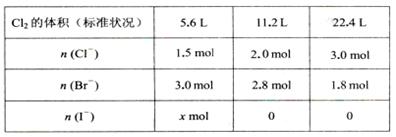
| A.5:15:4 | B.5:12:4 | C.15 : 30 : 8 | D.条件不足,无法计算 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应Z2+2A2+=2A3++2Z-可以进行 |
| B.Z元素在①反应中被氧化,在③反应中被还原 |
| C.还原性由强到弱的顺序是Z-,B-,A2+,X2+ |
| D.氧化性由强到弱的顺序是XO4-,Z2,B2,A3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2KCl+2FeCl2+I2
2KCl+2FeCl2+I2  2FeCl3 ③2KMnO4+16HCl
2FeCl3 ③2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O,若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是
2KCl+2MnCl2+5Cl2↑+8H2O,若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是| A.KMnO4 | B.FeCl3 | C.Cl2 | D.HCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.上述过程中,最终被还原的是NO3- |
| B.从上述反应可以得出结论,氧化性:HNO3>Fe3+>稀硫酸 |
| C.上述过程中,会产生一种无色难溶于水的气体 |
| D.假设通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积比为1:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| | 实验操作 | 实验现象 |
| I | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色。 |
| II | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化。 |
| III | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④ | C.③④⑤ | D.①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com