
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是

A. M为电池正极,CH3COOH被还原
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. 反应一段时间后,N极附近的溶液pH下降
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的一组是( )
A.K+、NH![]() 、CO
、CO![]() 、OH-B.Cu2+、Na+、NO
、OH-B.Cu2+、Na+、NO![]() 、Cl-
、Cl-
C.Na+、Ba2+、SO![]() 、I-D.H+、Fe2+、NO
、I-D.H+、Fe2+、NO![]() 、ClO-
、ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,雾霾天气成为我国华北地区乃至全国的环境问题之一。
Ⅰ汽车尾气是空气污染的重要原因。汽车尾气净化原理为:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H <0。
2CO2(g)+N2(g) △H <0。
(1)该反应的平衡常数表达式为____________________。
(2)在一恒容的绝热容器(不与外界发生热交换)中模拟上述反应。下面各示意图正确且能说明反应在t1时刻达到平衡状态的是__________。
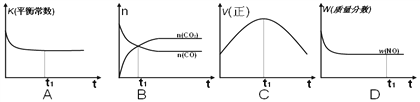
Ⅱ煤燃烧产生的烟气中含有大量硫、氮的氧化物,会引起严重的环境污染问题。
(1) 硫、氮的氧化物都会形成酸雨。为减少酸雨产生,下列措施中不可行的有_______(填序号)。
a.少用煤作燃料 b.把工厂的烟囱加高 c.燃料脱硫
d.燃煤时鼓入足量空气 e.开发新能源
(2)煤燃烧产生的氮的氧化物可以用CH4催化还原。已知:
CH4(g) + 2NO2(g) = N2(g) +CO2(g) + 2H2O(g) △H =-867kJ/mol
2NO2(g) = N2O4(g) △H =-56.9kJ/mol
H2O(l) = H2O(g) △H =+44kJ/mol
写出CH4(g) 还原N2O4(g)生成N2(g) 、CO2(g)和H2O(l)的热化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率、限度及能量与生产、生活密切相关。
(1)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2+3H2![]() 2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量___(填“大于”或“小于”)生成物化学键形成放出的总能量。
2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量___(填“大于”或“小于”)生成物化学键形成放出的总能量。
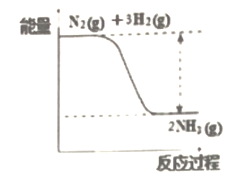
(2)小王同学为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 50 | 190 | 414 | 526 | 570 |
①求2~4分钟时间段以盐酸的浓度变化来表示的该反应速率___。(设溶液体积不变)
②小蒋同学认为在盐酸溶液中滴入少量的CuSO4溶液可以加快反应的速率,请从电化学的角度给子构成的原电池中负极反应式为___;溶液中H+移向___极(填“正“或“负")。
(3)某温度下在4L恒容密闭容器中,3种气态物质X、Y、Z的物质的量随时间变化曲线如图。
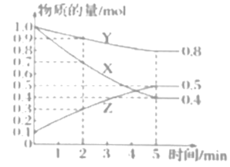
①写出该反应的化学方程式___。
②在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是___。
A.X、Y、Z的浓度相等
B.容器内气体压强保持不变
C.X、Y的反应速率比为3:1
D.生成1molY的同时生成2molZ
③该反应达平衡时,X的转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为分析某有机化合物A的结构,进行了如下实验:
(1)向NaHCO3溶液中加入A,有气体放出,说明A中含有___________官能团(写结构简式)。
(2)向NaOH溶液中加入少许A,加热一段时间后,冷却,用HNO3酸化后再滴加AgNO3溶液,产生淡黄色沉淀,说明中A还有___________官能团(写名称)。
(3)经质谱分析,Mr(A)=153,且A中只有四种元素,则A的分子式为___________。
(4)核磁共振氢谱显示,A的氢谱有3种,其强度之比为1︰2︰2,则A结构简式为___________。
(5)已知A可发生如下图所示的转化:
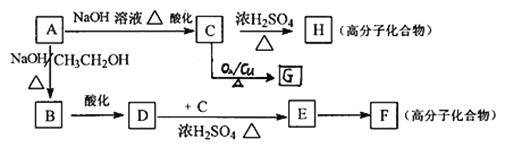
①A→B、D→E的反应类型分别为___________、___________。
②写出下列反应的化学方程式C→H:_________________________。
③C的同分异构体有多种,写出与C具有相同的官能团的C的同分异构体的结构简式:___________________________;写出F的结构简式:________________________。
④G与过量的银氨溶液反应,每生成2.16gAg,消耗G的物质的量是__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年3月,我国科学家研发出一种新型的锌碘单液流电池,其原理如图所示。下列说法不正确的是

A. 放电时B电极反应式为:I2+2e-=2I-
B. 放电时电解质储罐中离子总浓度增大
C. M为阳离子交换膜,N为阴离子交换膜
D. 充电时,A极增重65g时,C区增加离子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二元酸H2X易溶于水
(1)常温下,向0.1mol/L的酸式盐NaHX的溶液中滴入几滴紫色石蕊试液,溶液变成红色。
①若测得此溶液的pH=1,则NaHX溶于水时的电离方程式为__________
②若NaHX溶液中能检测到H2X分子,则溶液中c(X2-)__________(填>、<或=)c(H2X),c(X2-)+c(HX-)+c(H2X)=__________mol/L
(2)常温下,0.1mol/LNaHX溶液中存在的离子有Na+、X2-、HX-、H+、OH-,存在的分子只有H2O,且c(H+)=0.01mol/L
①该溶液中c(HX-)+c(X2-)=__________mol/L
②常温下,0.1mol/LH2X溶液中c(H+)________(填>、<或=)0.11mol/L
(3)若NaHX溶液中检测不到H2X分子但可检测到HX-,则溶液中c(H+)-c(OH-)________(填>、<或=)c(X2-),若HX-的电离平衡常数K=2.5×10-6,则0.4mol/L的NaHX溶液的pH约为__________
(4)常温下向20mL 0.05mol/L某稀酸H2X溶液中滴入0.1mol/L氨水,溶液中由水电离出来的氢离子浓度随滴入氨水体积变化如图,下列分析正确的是________(填字母代号)
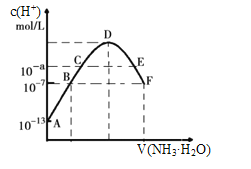
A.NaHX溶液可能为酸性,也可能为碱性
B.A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C.E点溶液中离子浓度大小关系:c(NH4+)>c(X2-)>c(OH-)>c(H+)
D.F点溶液:c(NH4+)=2c(X2-)
(5)已知某混合溶液中含有4molNa2X、2molNa2CO3和1molNaHCO3。往溶液中通入4molCO2气体,充分反应后气体全部被吸收,反应后Na2CO3和NaHCO3的物质的量分别为________,________(不考虑弱酸根离子的电离及水解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
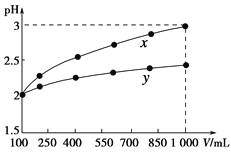
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温、常压下,50 mL三种气态烃的混合物与足量的氧气混合后点燃爆炸,恢复到原来状况时,体积共缩小100 mL,则三种烃可能是
A.CH4、C2H6、C3H4B.C2H6、C3H6、C4H6
C.CH4、C2H6、C3H8D.C2H4、C2H6、C2H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com