
(16分)某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究。
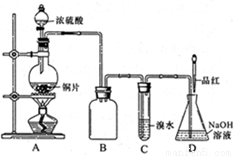
(1)装置A中发生反应的化学方程式
是_______,装置B的作用是_______。
设计装置C的目的是验证SO2的
_______________性,D中NaOH全部转化为
NaHSO3的标志是____________。
(3)反应结束时烧瓶中Cu有剩余,某
同学认为H2SO4也有剩余,他设计了下列实
验方案来测定剩余H2SO4的量。经冷却,定
量稀释后进行下列实验,能达到目的是________(填序号);
a. 用酸碱中和滴定法测定 b. 与足量Zn反应,测量生成H2的体积
c. 用PH计测溶液PH值 d. 与足量BaCl2溶液反应,称量生成沉淀的质量
(4)向D瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 滴加少量淀粉碘化钾溶液,振荡 |
| III |
② | 滴加少量棕红色的KI3溶液,振荡 |
| II |
③ | 滴入加少量酸性KMNO4溶液,振荡 | 溶液呈紫色 |
|
④ | 加入几小块CaCO3固体 | 有气泡产生 |
|
(共16分)
(1)Cu+2H2SO4(浓)△CuSO4+SO2↑+2H2O(2分)
防止C中液体倒吸入A中(或防倒吸,或安全瓶)(2分)
(2)还原(2分) 溶液红色褪去(2分)
(3)b c(2分)
(4)①溶液变为蓝色(1分) ②溶液褪色(1分)
③Ⅰ或Ⅲ(2分) ④Ⅰ或Ⅱ(2分)
【解析】
试题分析:(1)Cu与浓硫酸加热生成CuSO4、SO2和H2O,化学方程式为:Cu+2H2SO4(浓)△CuSO4+SO2↑+2H2O;因为SO2易溶于水,而且SO2能与溴水反应,容易产生倒吸,所以装置B的作用是:防止C中液体倒吸入A中。
(2)装置C中盛有溴水,具有较强的氧化性,设计装置C的目的是验证SO2的还原性;若NaOH全部转化为NaHSO3,不能与SO2反应,通入的SO2具有漂白性,能使品红褪色,所以D中NaOH全部转化为NaHSO3的标志是:溶液红色褪去。
(3)反应后的溶液含有CuSO4,由于溶液中有铜离子使溶液呈蓝色,不能指示反应的终点,所以不能用酸碱中和滴定法测定剩余酸的物质的量的浓度;CuSO4 能与BaCl2反应生成BaSO4沉淀,所以不能用与足量BaCl2溶液反应,称量生成沉淀的质量的方法测剩余H2SO4的量;根据与足量Zn反应,测量生成H2的体积、用PH计测溶液PH值可以求出剩余H2SO4的量,故bc正确。
(4)①漂白粉过量,过量的漂白粉把KI氧化为I2,使淀粉溶液变蓝。
②漂白粉不足,剩余NaHSO3,棕红色的KI3溶液氧化NaHSO3,生成无色的KI,所以现象为:溶液褪色。
③滴入加少量酸性KMNO4溶液,振荡,溶液呈紫色,说明NaHSO3已完全反应,可能为I. HSO3-与ClO-刚好反应完或III. 漂白粉过量。
④若HSO3-与ClO-刚好反应完,可生成HCl,能与CaCO3反应生成气泡;NaHSO3呈酸性,能与CaCO3反应生成CO2,所以I. HSO3-与ClO-刚好反应完、II. 漂白粉不足能与CaCO3反应生成气泡。
考点:本题考查实验方案的分析、化学方程式的书写。


科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:选择题
下列各组顺序的排列不正确的是( )
A.原子半径:Na>Mg>Al>H B.热稳定性: HC l<H2S<PH3
C.酸性强弱:H2SiO3<H2CO3<H3PO4 D.氧化性:K+<Na+<Mg2+<Al3+
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市二下学期期末考试化学试卷(解析版) 题型:填空题
(11分)根据下列有机物转化流程回答:
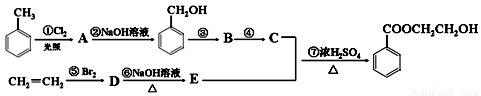
(1)写出A的结构简式: 。
(2)属于取代反应的有(填序号): 。属于加成反应的有(填序号): 。
(3)写出第①步反应的化学方程式:
____________________________________________________________________________
写出物质B与新制Cu(OH)2溶液反应的化学方程式:
___________________________________________________________________________
写出第⑥步反应的化学方程式:
___________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市二下学期期末考试化学试卷(解析版) 题型:选择题
下列各溶液中,相关微粒物质的量浓度关系不正确的是
A.0.1 mol·L-1NaHCO3溶液中:c(OH-)=c(H+)+c(H2CO3)-c(CO32-)
B.0.1 mol·L-1 NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)=0.1 mol·L-1
C.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
D.常温下,浓度为0.1 mol·L-1 NaHSO3溶液的pH<7:c(Na+)>c(HSO3-)>c(SO32-)> c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市二下学期期末考试化学试卷(解析版) 题型:选择题
下列有关溶液的叙述中,正确的是
A.中和10 mL 0.1 mol·L-1 醋酸与中和100 mL 0.01 mol·L-1的醋酸所需同种碱溶液的量不同
B.常温下,等体积的pH=3的酸溶液和pH=11的碱溶液混合,混合后溶液的pH=7
C.常温下,体积相等、pH相同的盐酸和硫酸溶液,两溶液溶质的物质的量浓度相等
D.常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
下列化学实验叙述正确的是
A. 实验室从海带中提取单质碘的步骤:取样→灼烧→溶解→过滤→萃取
B. 将饱和FeCl3溶液滴入沸水,继续加热煮沸至出现红褐色沉淀即得Fe(OH)3胶体
C. 要检验滴有稀硫酸的蔗糖溶液是否水解,可加入银氨溶液,再水浴加热
D. 钠的焰色反应实验需要用酒精灯、铂丝、氯化钠溶液和稀盐酸
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省眉山市高三第二次诊断性考试理综化学试卷(解析版) 题型:简答题
(16分)已知A、B、C、D、E、F、G和H都是元素周期表中前36号的元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的两倍,C的基态原子核外有7种不同运动状态的电子,E是电负性最大的元素,F的氢化物和最高价氧化物对应的水化物均为强酸,G、H分别是周期表中1—18纵列中的第10、12纵列元素。请回答下列问题:
(1)D元素在周期表位置是 ,G的核外价层电子排布式为 。
(2)E与A形成的化合物比F与A形成的化合物的沸点 (填“高”或“低”),其原因是 。
(3)B、C原子的第一电离能较大的是 (填元素符号),其原因是 。
(4)BD32-离子中B原子采取 杂化,任写一种与BD互为等电子体的分子的电子式 。
(5)元素H的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式是 。元素H的氢氧化物可溶于氨水中,生成和铜氨配离子相同配位数的离子,写出该反应的离子方程式为 。
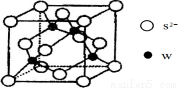
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省攀枝花市高一(下)学期调研检测化学试卷(解析版) 题型:选择题
可用下图所示装置制取(必要时可加热)、净化、收集的气体是
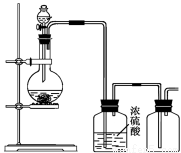
A.铜与稀硝酸反应制一氧化氮
B.氯化铵与氢氧化钙固体反应制氨气
C.锌和稀硫酸反应制氢气
D.亚硫酸钠固体与硫酸反应制二氧化硫
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市高第二期期末高一化学试卷(解析版) 题型:选择题
在一定温度下,容器内某一反应中两种气态物质M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )

A.反应的化学方程式为:2M N
N
B.t2时,正逆反应速率相等,反应达到平衡状态
C.t3时,M上a点正反应速率等于N上b点的逆反应速率
D.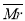 混一定时,N的体积百分含量也一定
混一定时,N的体积百分含量也一定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com