
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式。
该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,计算推进剂中联氨的质量。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为:
6NO+4NH3—→5N2+6H2O
6NO2+8NH3—→7N2+12H2O
NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g·cm-3。
计算:①该混合气体中NO与NO2的体积比。
②吸收后氨水的物质的量浓度(答案保留1位小数)。
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
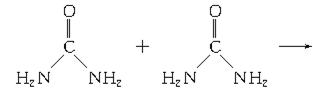
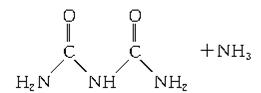
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80 mol NH3生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比。
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
某研究性学习小组在做Na2O2与水反应实验时,发现向Na2O2与水反应后的溶液中滴加酚酞试液,溶液呈现 红色,但红色很快褪去,甲、乙、丙三位同学对此现象分别做了如下推测:
红色,但红色很快褪去,甲、乙、丙三位同学对此现象分别做了如下推测:
甲:因为反应后试管很热,所以可能是溶液温度较高使红色褪去。
乙:因为所加水的量较少,红色褪去可能是生成的NaOH溶液浓度较大。
丙 :Na2O2具有强氧化性,生成物中O2、H2O2(可能产物)等也具有强氧化性,可能是氧化漂白了红色物质。
:Na2O2具有强氧化性,生成物中O2、H2O2(可能产物)等也具有强氧化性,可能是氧化漂白了红色物质。
(1)验证甲同学的推测是否正确的方法是__________________________,验证乙同学的推测是否 正确的方法是_______________________________________
正确的方法是_______________________________________ ______;当出现__________
______;当出现__________ ________________现象时,即可说明丙同学的推测正确。
________________现象时,即可说明丙同学的推测正确。
(2)有同学提出用定量的方法探究丙同学的推测中是否含有H2O2,其实验方法为:称取2.6 g Na2O2固体,使之与足量的水反应,测量产生O2的体积,与理论值比较,即可得出结论 。
。
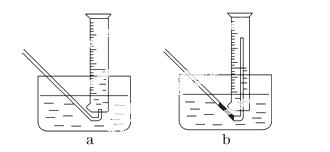
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用如图装置中的______________________________________________________,
理由是_________________________ _________________________________。
_________________________________。
②若在标准状况下测量气体的体积,应选 用的量筒的大小规格为________(填“100 mL”、“200 mL”、“500 mL”或“1000 mL”)。
用的量筒的大小规格为________(填“100 mL”、“200 mL”、“500 mL”或“1000 mL”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室模拟合成氨和氨催化氧化的流程如下:
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
(1)从下图中选择制取气体的合适装置
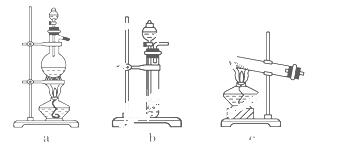
氮气____________、 氢气______________.
氢气______________.
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有__________、____________.
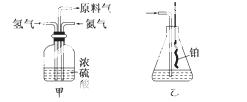
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,______(填“会”或“不会”)发生倒吸,原因是__________________________________________________________________________。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是____________________,锥形瓶中还可观察到的现象是______________。
(5)写出乙装置中氨氧化的化学方程式:___________________________________________。
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、__________、__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,两个等体积的干燥圆底烧瓶中分别充满:①NH3、②NO2,进行喷泉实验,如下图所示,经充分反应后,瓶内溶液的物质的量浓度为( )
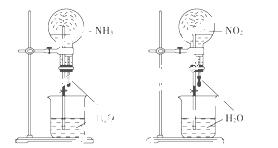
A.①>② B.①<②
C.①=② D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是 ( )
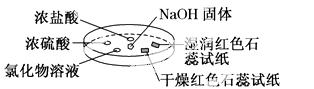
| 选项 | 实验现象 | 解释 |
| A | 浓盐酸附近产生白烟 | NH3与浓盐酸挥发的HCl气体反应产生了NH4Cl固体 |
| B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
| C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
| D | 干燥红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上将氨气和空气的混合气体通过铂铑合金网发生氨氧化反应,若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为 ( )
A.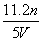 B.
B.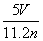 C.
C.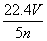 D.
D.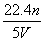
查看答案和解析>>
科目:高中化学 来源: 题型:
下列陈述和判正确、并且有因果关系的是( )
| 选项 | 陈述 | 判断 |
| A | Si有良好的半导体性能 | Si可用于制备光导纤维 |
| B | 在未知溶液加入稀硝酸和氯化钡溶液有沉淀生成 | 说明该未知溶液肯定含有SO42- |
| C | 在金属活动顺序表中,金属活动顺序:Fe>H>Cu>Hg>Ag | 要从矿石中冶炼得到金属单质,汞和银只需加热,而铁和铜必须用还原剂 |
| D | 锌锰干电池碳棒是正极,MnO2是氧化剂 | 锌锰干电池是二次电池,可以反复充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于金属元素在自然界存在的情况的叙述中,正确的是( )
A.金属元素仅存在于矿物中
B.金属元素存在于矿物和动物体内,植物体内不含
C.少数金属元素以游离态存在,大多数金属元素以化合态存在
D.金属元素在自然界中都以化合态形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
把一块镁铝合金投入到1mol/L 盐酸里,待合金完全溶解后,往溶液里加、
入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图A所示。下列说法中
不正确的是( )
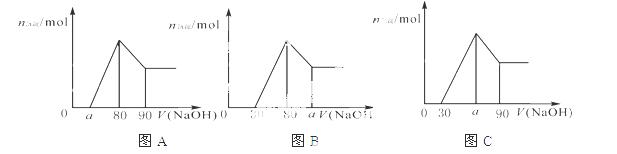 A.
A.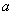 的取值范围为0≤ a<50
的取值范围为0≤ a<50
B.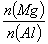 的最大值为2.5
的最大值为2.5
C.若将关系图改为B图时,则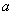 的取值范围为80<a<90
的取值范围为80<a<90
D.若将关系图改为C图时,则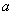 的取值范围为75<a<90
的取值范围为75<a<90
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com