
| A. | 乙烯与氯气反应生成的产物仍为平面结构 | |
| B. | 甲烷可以与氯气发生反应,因此可以使氯水褪色 | |
| C. | CHCl3只有一种结构,能说明甲烷是正四面体结构 | |
| D. | 邻二氯苯只有一种结构,说明苯环不是单双键交替结构 |
分析 A.乙烯为平面结构,乙烯与氯气加成后C为四面体构型;
B.甲烷与氯水不反应;
C.无论甲烷为正四面体还是正方形,CHCl3均有一种结构;
D.邻二氯苯只有一种结构,可知苯环上不含碳碳双键、单键.
解答 解:A.乙烯为平面结构,乙烯与氯气加成后C为四面体构型,则加成产物不是平面结构,故A错误;
B.甲烷与氯水不反应,不能使氯水褪色,故B错误;
C.无论甲烷为正四面体还是正方形,CHCl3均有一种结构,则CH2Cl2只有一种结构,能说明甲烷是正四面体结构,故C错误;
D.邻二氯苯只有一种结构,可知苯环上不含碳碳双键、单键,则说明苯环不是单双键交替结构,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应、有机物的结构等为解答的关键,侧重分析与应用能力的考查,注意结构的判断,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.8 mol•L-1•s-1 | D. | v (D)=1 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
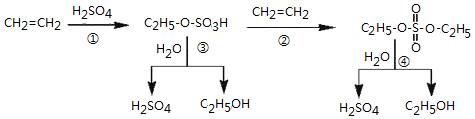
| A. | 该过程可以制取乙醇 | |
| B. | 已知C2H5-O-SO3H属于酯,所以该过程中①和②都是酯化反应 | |
| C. | 该过程中③和④是取代反应 | |
| D. | C2H5-O-SO3H具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量氯气与乙烷在光照条件下反应(氯乙烷) | |
| B. | 乙烯与水加成(乙醇) | |
| C. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| D. | 乙烯与氢气加成(乙烷) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46gNO2和N2O4的混合气体中含有的原子个数为3NA | |
| B. | 标准状况下,22.4L乙醇完全燃烧后生成的CO2分子数为2NA | |
| C. | 1mol苯中所含的碳碳双键数为3NA | |
| D. | 1mol Cl2与过量Fe反应,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
| 1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
| 2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
| 3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
| 4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
| 5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com