
【题目】亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH + H2![]() LiNH2+LiH。下列有关说法正确的是( )
LiNH2+LiH。下列有关说法正确的是( )
A. Li2NH中N的化合价是-1 B. 该反应中H2既是氧化剂又是还原剂
C. Li+和H-的离子半径相等 D. 此法储氢和钢瓶储氢的原理相同
科目:高中化学 来源: 题型:
【题目】下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336ml(标准状况)气体。回答下列问题:
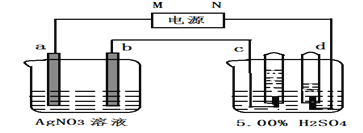
(1)根据图中c、d两极上产生气体的体积判断电源N极为_______极(填“正”或“负),电解池中a为______极。请写出a极的电极反应式:___________________.
(2) AgNO3溶液的浓度________(填“增大”“减小”或“不变”,下同),AgNO3溶液的pH_________,H2SO4溶液的浓度__________,H2SO4溶液的pH________.
(3)上述过程中通过电路的电子______mol.
(4)若H2SO4溶液中溶质的质量分数由5.00%变为5.02%,则原有的5.00%溶液为____g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组采用活性炭回收海带化工提碘废水中残留的低浓度碘(主要以I-形式存在,杂质不参与反应),实验过程如下:
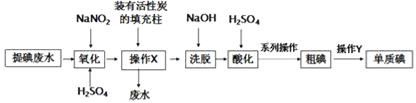
已知:3I2+6NaOH=5NaI+NaIO3+3H2O;
I2+2S2O32-=2I-+S4O62-。
请回答:
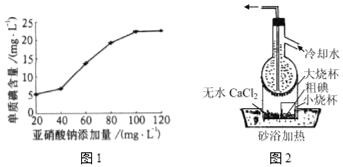
(1)结合图1可知,NaNO2最适宜的添加量为_____mgL-1。
(2)操作X的目的是_____。
(3)系列操作中涉及抽滤操作,下列有关抽滤的说法中不正确的是_____。
A.选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B.当溶液具有强酸性、强氧化性时,可用玻璃砂漏斗代替布氏漏斗
C.抽滤不宜过滤胶状沉淀,否则易在滤纸上形成一层密实的沉淀
D.洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀物
(4)进行操作Y时所用装置如图2所示(省去了夹持装置),则操作Y的名称为_____;该装置中有两处不合理,请指出其中的一处_____。
(5)称取0.5080g粗碘试样于250mL碘量瓶中,加入足量的KI溶液,加盖摇匀至碘完全溶解.迅速用0.1200molL-1Na2S2O3标准溶液滴定至浅黄色,再加入淀粉指示剂,继续滴定至蓝色褪去即为终点,共消耗Na2S2O3标准溶液24.00mL。则粗碘试样中碘单质的纯度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分,请回答有关问题:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素是 . (用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是 (用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程 .
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的 . (填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池用于航天飞船,电极反应产生的水,经冷凝后可作为航天员的饮用水,其电极反应如下:①2H2+4OH﹣﹣4e﹣=4H2O,②O2+2H2O+4e﹣=4OH﹣ 当得到1.8L饮用水时,电池内转移的电子数约为( )
A.1.8mol
B.3.6mol
C.100mol
D.200mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NH3催化还原氮的氧化物,可以消除氮的氧化物的污染。已知:
反应①:4NH3(g)+ 6NO(g)![]() 5N2(g) + 6H2O(l) △H1
5N2(g) + 6H2O(l) △H1
反应②:2NO(g) + O2(g)![]() 2NO2(g) △H2(△H2<0且
2NO2(g) △H2(△H2<0且![]() )
)
反应③:4NH3(g) + 6NO2(g)![]() 5N2(g)+ 3O2 + 6H2O(l) △H3
5N2(g)+ 3O2 + 6H2O(l) △H3
反应①和反应②在不同温度时的平衡常数及其大小关心如下表:
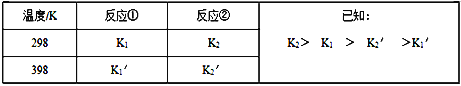
(1)试推测反应③是______ 反应(填“吸热”或“放热”)
(2)相同条件下反应①在2L的密闭容器中选用不同的催化剂,反应产生N2的物质的量随时间的变化如图所示。
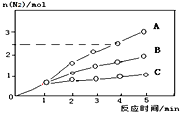
则:
①计算0~4min时在A催化剂作用下,反应速率v(NO)=__________。
②下列说法正确的是:__________________。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B) >Ea(C)
B.增大压强能使反应速率加快的原因,是因为增加活化分子的百分数
C.单位时间内H-O键与N-H断裂的数目相等时,说明反应已达平衡状态
D.若在恒容绝热的密闭容器中进行,当温度不变时,说明反应已达平衡状态
(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO和2 molO2,反应一段时间后,测的生成NO21.6mol,则该反应是否达到平衡状态?_______(填“是”或“不是”。已知该温度下该反应的K约为147.3)。达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和0.9mol的O2,则还要加入NO______mol、O2_____mol,达平衡时各物质的浓度才能跟前平衡的相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图。下列有关氢氧燃料电池的说法不正确的是
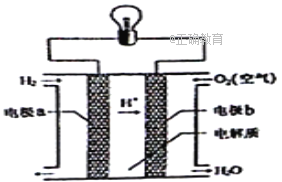
A. 该装置将化学能转化为电能
B. 为了增加灯泡亮度,可以将电极碳棒变得粗糙多孔
C. 电子迁移方向:电极a→灯泡→电极b→电解质溶液→电极a
D. 该电池的总反应:2H2+O2=2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com