
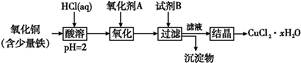

 Fe(OH)3+3H+,加入铜的化合物,可以与H+反应,促使平衡正向移动,最终生成Fe(OH)3沉淀,过滤即可。不可以加入NaOH、FeO,因为会带入新杂质。(3)含结晶水晶体的获得方法是:蒸发浓缩、冷却结晶。(4)CuCl2·xH2O 加热可以水解,无法获得CuCl2的真实质量。方案二,加入NaOH,可生成Cu(OH)2沉淀,然后加热分解得CuO,依据铜守恒可列式:
Fe(OH)3+3H+,加入铜的化合物,可以与H+反应,促使平衡正向移动,最终生成Fe(OH)3沉淀,过滤即可。不可以加入NaOH、FeO,因为会带入新杂质。(3)含结晶水晶体的获得方法是:蒸发浓缩、冷却结晶。(4)CuCl2·xH2O 加热可以水解,无法获得CuCl2的真实质量。方案二,加入NaOH,可生成Cu(OH)2沉淀,然后加热分解得CuO,依据铜守恒可列式: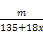 =
= ,由此可解得x值。
,由此可解得x值。

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
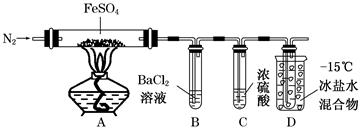
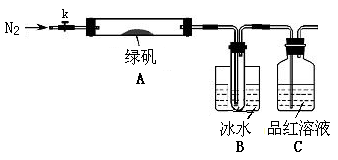
| 实验 | 实验过程 | 实现现象 |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
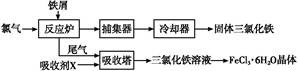
 Fe2++Cr3+
Fe2++Cr3+
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
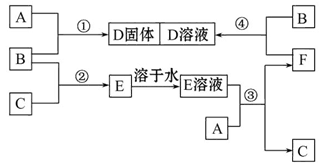
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1∶1 | B.2∶1 | C.1∶7 | D.2∶7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com