
(1)8 g CH4的物质的量为 ,在标准状况下所占的体积约为 ;
(2)100mL 1 mol·L-1Al2(SO4)3溶液中含Al3+离子 mol,含SO42-离子 个。
(3)0.6mol O2与0.4mol O3质量之比为 ,分子个数之比为 ,原子个数之比 ,它们在同温同压下的体积比是 。
(每空2分,共8分)(1)0.5mol;11.2L (2)0.2;1.806X1023个 (3)1:1;3:2;1:1;3:2
解析试题分析:(1)甲烷的摩尔质量是16g/mol,则根据n= 可知,8 g CH4的物质的量=8g÷16g/mol=0.5mol;标准状况下气体的摩尔体积是22.4L/mol,则根据n=
可知,8 g CH4的物质的量=8g÷16g/mol=0.5mol;标准状况下气体的摩尔体积是22.4L/mol,则根据n=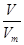 可知,在标准状况下所占的体积约为0.5mol×22.4L/mol=11.2L。
可知,在标准状况下所占的体积约为0.5mol×22.4L/mol=11.2L。
(2)100mL 1 mol·L-1Al2(SO4)3溶液中硫酸铝的物质的量=0.1L×1mol/L=0.1mol,则根据Al2(SO4)3=2Al3++3SO42-可知,溶液中含Al3+离子的物质的量=0.1mol×2=0.2mol。溶液中含SO42-离子的物质的量=0.1mol×3=0.3mol,则个数=0.3mol×6.02X1023/mol=1.806X1023个。
(3)氧气和臭氧的相对分子质量分别是32和48,则根据n= 可知,0.6mol O2与0.4mol O3质量之比为0.6mol×32g/mol:0.4mol×48g/mol=1:1;根据N=nNA可知,分子个数之比为0.6mol:0.4mol=3:2;原子个数之比=0.6mol×2:0.4mol×3=1:1;根据n=
可知,0.6mol O2与0.4mol O3质量之比为0.6mol×32g/mol:0.4mol×48g/mol=1:1;根据N=nNA可知,分子个数之比为0.6mol:0.4mol=3:2;原子个数之比=0.6mol×2:0.4mol×3=1:1;根据n=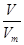 可知,它们在同温同压下的体积比=0.6mol:0.4mol=3:2。
可知,它们在同温同压下的体积比=0.6mol:0.4mol=3:2。
考点:考查物质的量、微粒数、气体体积以及物质的量浓度的有关计算


科目:高中化学 来源: 题型:填空题
三氯化铁是一种很重要的铁盐,主要用于污水处理,具有效果好、价格便宜等优点。工业上可将铁屑溶于盐酸中,先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液。
(1)将标准状况下的a L氯化氢气体溶于100 g水中,得到的盐酸的密度为b g·mL-1,则该盐酸的物质的量的浓度是________。
(2)向100 mL的FeBr2溶液中通入标准状况下Cl2 3.36 L,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为________。
(3)FeCl3溶液可以用来净水,其净水的原理为______________________________________(用离子方程式表示),若100mL 2mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数________0.2NA(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
计算:
Ⅰ、(1)0.3 mol NH3分子中所含氢原子数与_______NA个H2O分子中所含氢原子数相等。
(2)在标准状况下36 克CO和CO2的混合气体的体积为22.4L,则此混合气体中CO物质的量为 ;CO2的质量为 g 。
(3)将标准状况下224 L HCl气体溶于635 mL水中(ρ=1 g/cm3),所得盐酸的密度为1.18 g/cm3。则此盐酸的物质的量浓度为 。
(结果保留至小数点后1位)
Ⅱ、某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。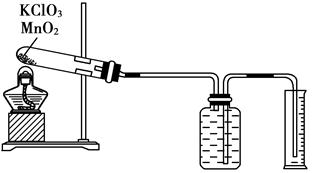
(1)实验步骤如下:
①连接好实验装置,检查装置的气密性。
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成T℃,101kPa氧气的体积为360.0 mL。
⑤准确称量试管和残留物的质量为15.55 g。
(2)利用以上数据,本实验测得T℃,101kPa的气体摩尔体积为
(结果保留至小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
(1)该浓硫酸的物质的量浓度为__________mol/L。
(2)取用任意体积的该硫酸溶液时,下列物理量中不随所取体 积的多少而变化的是__________。
A.溶液中H2SO4的物质的量 B.溶液的浓度
C.溶液中SO42-的数目 D.溶液的密度
(3)某学生欲用上述浓硫酸和蒸馏水配制480 mL物质的量浓度为0.2 mol/L稀硫酸。
①该学生需要量取________mL上述浓硫酸进行配制。
②配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)________________;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓硫酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的硫酸沿玻璃棒注入一定体积的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
③在配制过程中,下列实验操作使所配制的稀硫酸的物质的量浓度偏高的是_________
A.用量筒量取浓硫酸时仰视观察凹液面
B.稀释用的烧杯和玻璃棒未洗涤
C.洗净的容量瓶未经干燥就用于配制溶液
D.溶液注入容量瓶前没有恢复到室温就进行定容
E.定容时俯视观察凹液面
F.加水超过刻度线后,用胶头滴管吸出多余的液体
④现将100mL该硫酸与300mL 0.4mol/LCuSO4溶液混合,体积变化忽略不计,所得溶液中SO42-的物质的量浓度是_________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为________。
(2)在25℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________。
(3)A、B两种气体组成的混合气体8.6 g,在标准状况下体积为8.96 L。已知A与B的物质的量之比为3∶1,相对分子质量之比为14∶1,由此可推断B可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请完成下列填空:
(1)当SO2和SO3中分子个数比为1∶1 时,原子总数之比为 ,质量之比为 。
(2)中和含0.2 mol HCl的稀盐酸,需NaOH的质量为 g。
(3)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1,则:
①该气体的物质的量为 mol。
②该气体在标准状况下的体积为 L。
③该气体溶于水后形成V L溶液(不考虑反应),其溶液的物质的量浓度为 mol/L。
(4)将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度是 mol/L。
(5)用等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中的SO42-恰好完全沉淀,则三种硫酸盐的物质的量浓度之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)18gH2O的物质的量是 ,含有 个氢原子(填具体数字);这些H2O与 gOH-所含电子数相等。
(2)标准状况下,①6.72L CH4 ②3.01×1023HCl分子 ③0.2molNH3 ,这三种气体按物质的量由大到 小排列的顺序是(填物质的数字代号,下同) ,按氢原子数由多到少排列的顺序是 ,密度由大到小排列的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有25℃101KPa条件下的氯化氢(HCl)气体49L(注:25℃101KPa条件下气体摩
尔体积为24.5L/mol)则:
①该气体所含原子总数为________________个。
②该气体的质量为_____________g。
③该气体溶于127mL水中,得到密度为1.20g/mL的盐酸,此盐酸的物质的量浓度为______________。④取出20.0 mL该溶液,配成浓度为2.00 mol/L的稀溶液,则稀释后溶液的体积是_________ ml。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
下表是用沉淀法测定KHCO3和Na2CO3混合物的组成的相关数据。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。实验记录见下表:
| 实验次数 | 称取样品的 质量/g | 所加Ba(OH)2 溶液的体积/L | 测得生成沉淀 的质量/g |
| 1 | 0.518 | 0.5 | 0.985 |
| 2 | 1.036 | 0.5 | |
| 3 | 1.554 | 0.5 | 2.955 |
| 4 | 2.072 | 0.5 | 3.940 |
| 5 | 2.590 | 0.5 | 3.940 |
| 6 | 3.108 | 0.5 | 3.940 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com