
下列事实不能说明Cl原子的得电子能力比S原子强的是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强 ④Cl2能与 H2S反应生成S
H2S反应生成S
⑤Cl原子最外层有7个电于,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①②
C.①②④ D.①③⑤
科目:高中化学 来源: 题型:
某地污水中含有Zn2+、Hg2+、Fe3+和Cu2+4种阳离子。甲、乙、丙3位同学设计的从该污水中回收金属铜的方案如下。
甲:
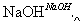

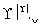
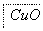
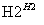
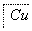
乙:
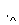


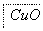
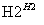
丙:



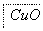
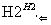
下列判断正确的是 ( )。
A.三种实验方案中都能制得纯净的铜
B.乙方案中加过量铁粉可以将4种阳离子全部还原
C.甲方案中的反应涉及置换、分解、化合、复分解4种反应类型
D.丙方案会产生环境污染
查看答案和解析>>
科目:高中化学 来源: 题型:
两个体积相同的容器,一个盛有NH3,另一个盛有N2和O2,在同温、同压下,两容器内的气体一定具有相同的
A.原子总数 B. 分子总数 C. 电子总数 D.质量
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学需用胆矾晶体(CuSO4·5H2O )配制0.2mol/L的CuSO4溶液480mL,
(1)所需仪器为:玻璃棒、托盘天平、药匙、 胶头滴管、量筒,还需要哪些玻璃仪器才能完成该实验,请写出:① ② 。
(2)补充完整该实验步骤①计算 ②称量胆矾 g ③溶解 ④冷却转移
⑤ ⑥定容 ⑦摇匀。
(3)定容时的操作为 。
(4)下列情况对所配制的CuSO4溶液浓度有何影响?(填“偏大”“偏小”“无影响”)
A.容量瓶用蒸馏水洗涤后残留有少量的水_____
B.定容时仰视刻度线___________
C.溶液未经冷却就立即转移
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。已知:甲+乙===丁+己,甲+丙===戊+己;0.1 mol·L-1丁溶液的pH为13(25 ℃)。下列说法中正确的是( )。
A.原子半径:W>Z>Y>X
B.Y元素在周期表中的位置为第三周期第ⅣA族
C.1 mol甲与足量的乙完全反应共转移了1 mol电子
D.1.0 L 0.1 mol·L-1戊溶液中阴离子总的物质的量小于0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大。A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大;B、C和F在周期表中相 邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y);D形成的分子为双原子分子。回答问题:
(1)D元素的名称为________,F形成的离子的结构示意图为 _________________________________________________________________ ___。
(2)写出液态化合物Y的一种用途_____________________________________________
____________________________________________________ ____________________。
____________________。
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气 球,请写出该反应的离子方程式______________________________________,
使用这种气球存在的隐患是______________________________________________
________________________________________________________________________。
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质 的量的P和Q恰好完全反应。写出该反应的离子方程式: ________________________________________________________________________
________________________________________________________________________。
(5)A、B、G三种元素两两组合形成的化合物在空气中相遇形成白烟,反应的化学方程 式为
_______________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
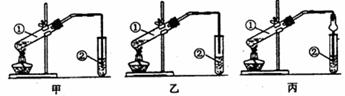
(1)甲、乙、丙三位同学分别设计了如图所示的三套实验装置,请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,应选择的装置是 (填“甲”或“乙”)丙同学设计了丙装置,用球形干燥管代替玻璃管,除起到冷凝作用外,另一重要的作用是: 。
(2)浓硫酸的作用是:① ;② 。
(3)右边试管所加试剂是 ,它的作用是中和乙酸、溶解乙醇,还可以是 。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 ,使用的实验仪器是 。
(5)生成乙酸乙酯的反应是可逆反应,下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水;
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸;
④正反应的速率与逆反应的速率相等;
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com