
纯醋酸在常温下为晶体,俗称冰醋酸。向冰醋酸中加水,加水量与导电能力如图所示,请完成下列问题:

(1)图中“O”点导电能力为0的原因是____________________________________________。
(2)A、b、C三点溶液H+浓度由大到小顺序是________________________________________。
(3)A、b、C三点中,CH3COOH电离程度最大的是_____________________________________。
(4)若使C点溶液中C(CH3COO-)增大而C(H+)减小的措施有_____________________________。
A.加入NAOH固体 B.加入CH3COONA晶体
C.加入镁粉 D.加入冰醋酸
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
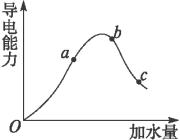
(1)图中“O”点导电能力为0的原因是_______________________________________。
(2)A、b、C三点溶液H+浓度由大到小顺序是________________。
(3)A、b、C三点中,CH3COOH电离程度最大的是___________。
(4)若使C点溶液中C(CH3COO-)增大而C(H+)减小的措施有_____________。
A.加入NaOH固体 B.加入CH3COONa晶体
C.加入镁粉 D.加入冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ)(9分)
现有下列物质: ①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的物质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(Ⅱ)现有下列电解质溶液:①![]() ②
②![]() ?③
?③![]() ? ④
? ④![]() ⑤
⑤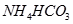 (已知酸性
(已知酸性![]() 。)
。)
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号) 。
(2)常温下,物质的量浓度相同的①、②、③溶液pH大小顺序为(填序号) > > 。
(3)写出⑤与足量NaOH溶液混合加热时反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三下学期质量检测(三)化学试卷(解析版) 题型:填空题
(12分)氮元素可形成卤化物、叠氮化物及络合物等。
(1)NF3构型为三角锥体,沸点-129 ℃;可在铜催化作用下由F2和过量NH3反应得到。
NF3属于 晶体,写出制备 NF3的化学反应方程式: 。
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-。
①与N3-互为等电子体的分子、离子有: 、 (各举1例),由此可推知N3-的空间构型是 型。
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:[Co (N3)(NH3)5]SO4、
Fe(CN)64-。写出钴原子在基态时的价电子排布式: 。
[Co (N3)(NH3)5]SO4中钴的配位数为 ,CN—中C原子的杂化类型是 。
(3)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体可溶于水,则该异构体是 (填“极性”、“非极性”)分子。
(4)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是 (选填序号)
A.NaN3与KN3结构类似,前者晶格能较小
B.第一电离能(I1):N>P>S
C.钠晶胞结构如图,该晶胞分摊2个钠原子

D.氮气常温下很稳定,是因为氮的电负性小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com