
【题目】盐酸法是在一定温度下盐酸与铝土矿、高岭土或粉煤灰等固体中的活性Al2O3发生反应制备Al2O3的工艺。氯化铝溶液可通过蒸发结晶生成结晶氯化铝,进而焙烧得到氧化铝;也可利用氯化铝在酸溶液中的溶解度随着盐酸浓度的升高而急剧降低的特点,生成氯化铝晶体,从而焙烧得到氧化铝。图1是我国某公司研发的具有自主知识产权的“一步酸溶法”工艺流程。
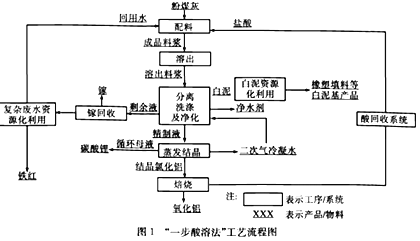
回答下列问题:
(1)“氯化铝在酸溶液中的溶解度随着盐酸浓度的升高而急剧降低”的原因是________________________________________________________(结合必要的化学方程式说明)。
(2)精制液蒸发结晶后分离出纯净结晶氯化铝的操作名称是_______,用_____洗涤。
(3)写出结晶氯化铝(AlCl3·6H2O)焙烧的化学方程式:_____________________________。
(4)工业上冶炼金属铝的方法是电解熔融的_______(填化学式),电解过程中作阳极的石墨易消耗,原因是___________________________。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_______________________________________。
【答案】 AlCl3溶液中存在水解平衡AlCl3+3H2O![]() Al(OH)3+3HCl,及结晶溶解平衡AlCl3(s)
Al(OH)3+3HCl,及结晶溶解平衡AlCl3(s)![]() Al3+(aq)+3Cl-(aq),盐酸浓度越大,两平衡都向左移动,AlCl3溶解度越小 过滤 浓盐酸 2(AlCl3·6H2O)
Al3+(aq)+3Cl-(aq),盐酸浓度越大,两平衡都向左移动,AlCl3溶解度越小 过滤 浓盐酸 2(AlCl3·6H2O) ![]() Al2O3+6HCl+9H2O Al2O3 石墨电极被阳极上产生的O2氧化 NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜
Al2O3+6HCl+9H2O Al2O3 石墨电极被阳极上产生的O2氧化 NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜
【解析】(1) AlCl3溶液中存在水解平衡AlCl3+3H2O![]() Al(OH)3+3HCl,及结晶溶解平衡AlCl3(s)
Al(OH)3+3HCl,及结晶溶解平衡AlCl3(s)![]() Al3+(aq)+3Cl-(aq),盐酸浓度越大,氢离子、氯离子浓度均增大,两平衡都向左移动,AlCl3溶解度越小,所以氯化铝在酸溶液中的溶解度随着盐酸浓度的升高而急剧降低;正确答案:AlCl3溶液中存在水解平衡AlCl3+3H2O
Al3+(aq)+3Cl-(aq),盐酸浓度越大,氢离子、氯离子浓度均增大,两平衡都向左移动,AlCl3溶解度越小,所以氯化铝在酸溶液中的溶解度随着盐酸浓度的升高而急剧降低;正确答案:AlCl3溶液中存在水解平衡AlCl3+3H2O![]() Al(OH)3+3HCl,及结晶溶解平衡AlCl3(s)
Al(OH)3+3HCl,及结晶溶解平衡AlCl3(s)![]() Al3+(aq)+3Cl-(aq),盐酸浓度越大,两平衡都向左移动,AlCl3溶解度越小。
Al3+(aq)+3Cl-(aq),盐酸浓度越大,两平衡都向左移动,AlCl3溶解度越小。
(2)固液分离采用过滤操作,因此精制液蒸发结晶后分离出纯净结晶氯化铝的操作是过滤;由于氯化铝溶液水解显酸性,浓盐酸能抑制其水解,洗涤时减小氯化铝晶体的损失;正确答案:过滤; 浓盐酸。
(3) 氯化铝(AlCl3·6H2O)加热后水解生成氢氧化铝,氢氧化铝灼烧后生成氧化铝,化学方程式:2(AlCl3·6H2O) ![]() Al2O3+6HCl+9H2O;正确答案:2(AlCl3·6H2O)
Al2O3+6HCl+9H2O;正确答案:2(AlCl3·6H2O) ![]() Al2O3+6HCl+9H2O。
Al2O3+6HCl+9H2O。
(4)金属铝活泼性较强,工业上用电解熔融的氧化铝得到金属铝,阳极发生极反应为:2O2—-4e-=O2↑,反应生成的氧气与石墨(主成分为碳)电极发生反应生成二氧化碳,造成阳极的石墨被消耗;正确答案:Al2O3 ;石墨电极被阳极上产生的O2氧化。
(5)铝表面有氧化膜(Al2O3), NH4Cl分解产生的HCl能够与Al2O3反应,Al表面的Al2O3薄膜被反应掉,有利于铝粉与氮气反应生成AlN;正确答案:NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜。


科目:高中化学 来源: 题型:
【题目】(1)基态溴原子的核外电子排布式为________,其核外电子所占用的最高能级电子云形状为_________。
(2)尿素(H2NCONH2)分子中,原子杂化轨道类型有_____,σ键与π键数目之比为______。
(3)铍与铝元素性质相似。下列有关铍与铝的叙述正确的是_____ (填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液都呈酸性
(4)NH3分子中∠HNH键角为107°,而配离子[Zn(NH3)6]2+中∠HNH的键角为109.5°。配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是_______。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
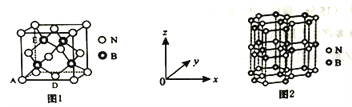
①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为(0.5,0.5,0),则E原子的坐标参数为________。
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的表达式为___pm.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cu与CuO的混合物20.8g加到50mL 18.4molL﹣1浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000mL,测得c(Cu2+)=0.3molL﹣1。(以上过程中硫酸始终是浓硫酸,不考虑气体在水中的溶解)试计算:
(1)反应过程中放出的气体在标准状况下的体积为________L。
(2)溶解稀释后,氢离子的浓度为_________molL﹣1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置从海水中提取CO2,有利于减少环境中温室气体的含量。下列说法正确的是

A. 通电后,a室的pH增大
B. 中间隔室发生的反应:HCO3-+H+==CO2↑+H2O,从而提取CO2
C. 阴极反应式为2H+-2e-==H2↑
D. 当电路中通过1mol电子的电量时,会有22.4LCO2气体产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了如下装置制取和验证SO2的性质。

请回答:
(1)写出图中仪器的名称:a___________,b___________。
(2)棉球中NaOH溶液的作用是______________________。
(3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_____________________。
A.紫色石蕊试液 B.无色酚酞试液 C.澄清石灰水 D.碘水
(4)下列说法正确的是____________。
A.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
B.先向装置中加入试剂(药品),再进行气密性检查
C.实验开始后,洗气瓶①和③只溶液均褪色,两者均可证明SO2具有漂白性
D.实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性
(5)洗气瓶④中发生反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胰蛋白酶作用于一定量的某种物质(底物),温度保持37 ℃,pH保持在最适值,生成物量与反应时间关系如下图。请回答下列问题。

(1)该酶作用的底物是 。
(2)在140 min后,曲线变成水平,这是因为
________________________________________________________________________。
(3)若增加胰蛋白酶浓度,其他条件不变,请在原图上画出生成物量变化的示意曲线。
(4)若胰蛋白酶浓度和其他条件不变,反应液pH由2逐渐升高到10,则酶催化反应的速率将________,原因是____________________________________。
(5)下图中能正确表示胰蛋白酶对底物的分解速率和温度关系的是( )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某致病细菌分泌的外毒素,无色,细针状结晶,对小鼠和人体有很强的毒性,可引起流涎、呕吐、便血、痉挛等,以致死亡。该外毒素为环状肽,结构式如图所示,请据图分析回答:

(1)该化合物中含有游离的氨基_____________个,羧基________________个。
(2)该化合物是由_____________个氨基酸组成的,区别这些氨基酸的种类是依靠其结构中的_____________。
(3)组成该化合物的氨基酸有___________种,其中有_____________个氨基酸的R基相同,这个R基是_______________。
(4)该化合物称为环状__________肽化合物,含有___________个肽键。
(5)填写虚线框内结构的名称:A._________________,B.___________________。
(6)该化合物具有8个氮原子,其中_____________个位于肽键上,____________个位于R基上。
(7)该外毒素环肽在形成过程中失去了______________个水分子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com