
)下列溶液中微粒的物质的量浓度关系正确的是( )
|
| A. | Ca(ClO)2溶液中:c(Ca2+)>c(ClO﹣)>c(OH﹣)>c(H+) |
|
| B. | 等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+)=c(X﹣)>c(OH﹣)=c(H+) |
|
| C. | 常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(NH4+)>c(Cl﹣)>c(NH3•H2O)>c(OH﹣)>c(H+) |
|
| D. | 将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(S2﹣)+2c(OH﹣)=2c(H+)+c(HS﹣)+3c(H2S) |
考点:
离子浓度大小的比较;盐类水解的应用;酸碱混合时的定性判断及有关ph的计算.
专题:
电离平衡与溶液的pH专题;盐类的水解专题.
分析:
A、次氯酸根离子水解溶液呈碱性,水解程度微弱;
B、溶液中X﹣的水解和HX的电离程度比较确定溶液酸碱性,电离大于水解,溶液呈酸性,电离小于水解,溶液呈碱性;
C、将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合生成氯化铵,同时剩余氨水,等浓度氯化铵和一水合氨溶液中,一水合氨电离大于铵根离子的水解,溶液呈碱性,c(NH4+)>c(Cl﹣)>c(NH3•H2O);
D、将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,依据电荷守恒为:2c(S2﹣)+c(OH﹣)+(HS﹣)=c(H+)+c(Na+);
物料守恒为:2c(Na+)=3c(S2﹣)+3c(H2S)+3(HS﹣);两室合并计算得到;
解答:
解:A、次氯酸根离子水解溶液呈碱性,水解程度微弱,离子浓度大小为c(ClO﹣)>c(Ca2+)>c(OH﹣)>c(H+),故A错误;
B、溶液中X﹣的水解和HX的电离程度比较确定溶液酸碱性,电离大于水解,溶液呈酸性,电离小于水解,溶液呈碱性,故B错误;
C、将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合生成氯化铵,同时剩余氨水,等浓度氯化铵和一水合氨溶液中,一水合氨电离大于铵根离子的水解,溶液呈碱性,c(NH4+)>c(Cl﹣)>c(NH3•H2O),溶液中离子浓度大小为:c(NH4+)>c(Cl﹣)>c(NH3•H2O)>c(OH﹣)>c(H+),故C正确;
D、将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,依据电荷守恒为:2c(S2﹣)+c(OH﹣)+(HS﹣)=c(H+)+c(Na+);物料守恒为:2c(Na+)=3c(S2﹣)+3c(H2S)+3(HS﹣);两室合并计算得到所得溶液中:c(S2﹣)+2c(OH﹣)=2c(H+)+c(HS﹣)+3c(H2S),故D正确;
故选CD.
点评:
本题考查了电解质溶液中的离子浓度大小比较分析,电荷守恒、物料守恒的计算应用,题目难度中等.


科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
|
| A. | 7.8 g苯中含有0.3NA个碳碳双键,0.3NA个碳碳单键 |
|
| B. | 5.6 g铁与足量的稀硝酸反应,失去电子数为0.2NA |
|
| C. | 32g硫(结构见图)含S﹣S的数目为NA
|
|
| D. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
为测定镁铝合金(不含其它元素)中铝的质量分数,甲、乙、丙三个学习小组设计了下列三种不同的实验方案进行探究.请回答下列问题:
(一)甲组:实验方案:镁铝合金 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称量:托盘天平称量一定质量镁铝合金粉末
②溶解:将①中药品加入烧杯中,加入过量的 NaOH 溶液,不断搅拌,充分反应.发生反应的离子方程式为: ↑
③过滤:
④洗涤:若未对过滤所得固体进行洗涤,测得铝的质量分数将 (填“偏高”、“偏低”或“不变”)
⑤干燥、称量剩余固体
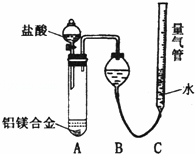
(二)乙组:实验方案:镁铝合金 测定生成气体的体积,实验装置如图所示.
测定生成气体的体积,实验装置如图所示.
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个装有碱石灰的干燥装置.你的意见是
(填“需要”或“不需要”)
(2)为使测定结果尽可能精确,实验中应注意的问题是(要求写出二点): 、
(三)丙组:实验方案:12g镁铝合金 溶液
溶液
操作1包括过滤、洗涤、干燥和称量,并最终得到固体物质1.45g.则该合金中铝的质量分数为 95% .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于取代反应的是( )
|
| A. | C2H4+3O2 | B. | Zn+CuSO4═ZnSO4+Cu |
|
| C. | NaCl+AgNO3═AgCl↓+NaNO3 | D. | CH2Cl2+Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
由乙烯推测丙烯(CH2═CH﹣CH3)的结构或性质不正确的是( )
|
| A. | 能使酸性高锰酸钾溶液褪色 |
|
| B. | 能在空气中燃烧 |
|
| C. | 能使溴水褪色 |
|
| D. | 与HCl在一定条件下能加成只得到一种产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了 .氯化铁水溶液呈 性,原因是(用离子方程式表示): .
(2)物质的量浓度均为0.1mol/L的下列溶液pH 由大到小的顺序 (用序号表示)
①CH3COOH ②NH4Cl ③NaHCO3 ④Ba(OH)2 ⑤NaOH ⑥Na2CO3
(3)物质的量浓度相同的下列溶液按c(CO32﹣)由大到小的顺序是
①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学研究的正确说法是( )
|
| A. | 同时改变两个变量来研究反映速率的变化,能更快得出有关规律 |
|
| B. | 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 |
|
| C. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
|
| D. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间/s 浓度mol•L﹣1 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)mol•L﹣1 | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2)/mol•L﹣1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)达到平衡时N2O4的转化率为 %.
(2)20s的四氧化二氮的浓度c1= mol•L﹣1,在0s~20s内四氧化二氮的平均反应速率为 mol•(L•s)﹣1;.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质与应用均正确的是( )
A. SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力
B. Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒
C. 氨气是一种碱性气体,可用碱石灰或无水CaCl2干燥
D. MgO的熔点很高,可用于制作耐高温材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com