
| A. | “84”消毒液与“洁厕灵混合使用,去污效果更好” | |
| B. | 利用盐酸刻蚀石英制作艺术品 | |
| C. | 福尔马林可用于保存海鲜制品 | |
| D. | “地沟油”经过加工处理可用于制生物柴油 |
分析 A.洁厕灵与84消毒液混合使用可生成有毒气体氯气;
B.盐酸与二氧化硅不反应;
C.福尔马林为甲醛的水溶液,甲醛有毒;
D.地沟油成分为油脂,油脂经过加工处理制得肥皂或生物柴油.
解答 解:A.洁厕灵与84消毒液混合使用可生成有毒气体氯气,易中毒,故A错误;
B.利用盐酸与二氧化硅不反应,氢氟酸能够与二氧化硅反应,所以用氢氟酸刻蚀石英制作艺术品,故B错误;
C.福尔马林为甲醛的水溶液,甲醛有毒,不能用于食品漂白,故C错误;
D.“地沟油”经过加工处理制得肥皂或生物柴油,可以实现厨余废物合理利用,既能节能减排又能充分利用资源而减少对社会的危害,故D正确;
故选:D.
点评 本题考查了环境污染及治理,明确物质的性质是解本题关键,涉及化学与生活,该知识在高考中每年都有,涉及知识点较广但较简单.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:多选题
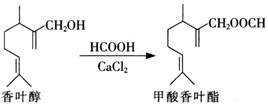
| A. | 香叶醇分子中含有1个手性碳原子 | |
| B. | 香叶醇可发生消去、加成、氧化反应 | |
| C. | 1 mol甲酸香叶酯可以与1molNaOH反应 | |
| D. | 甲酸香叶酯分子中所有碳原子均可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
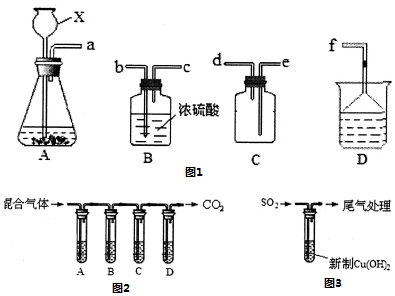
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 物质 | 甲 | 乙 | 丙 |
| A | Al2O3 | H2SO4 | NaOH |
| B | NO2 | HNO3 | NH3 |
| C | SiO2 | HF | NaOH |
| D | SO2 | Ca(OH)2 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
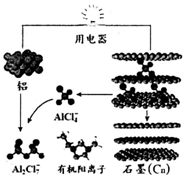 2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,该电池以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,电子山石墨电极经用电器流向铝电极 | |
| B. | 充电时,铝电极上发生氧化反应 | |
| C. | 充电时,AlCI4-向铝电极方向移动 | |
| D. | 放电时,负极反应为:Al-3e-+7 AlCl4-═4A12C17- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O | |
| C. | 钠与水反应:Na+H2O=Na++OH-+H2↑ | |
| D. | 铜跟稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 二价铬不稳定,极易被氧气氧化.醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂.实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:
二价铬不稳定,极易被氧气氧化.醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂.实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有CaCl2和Na2CO3,一定没有KI,可能有NaNO3 | |
| B. | 一定有KI、Na2CO3,可能有NaNO3、CaCl2 | |
| C. | 一定有KI、Na2CO3,可能有NaNO3,一定没有CaCl2 | |
| D. | 只有Na2CO3,可能有NaNO3,一定没有KI、CaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com