
【题目】碘及其化合物主要用于医药、照相及染料等。碘是合成碘化物的基本原料。空气吹出法从卤水中提碘的流程如下:

回答下列问题:
(1)“氧化”时,Cl2过量会将I2氧化为HIO3,写出生成HIO3的化学方程式_________;
(2)“吹出”在吹出塔中进行,含碘卤水从_________(填“塔顶”或“塔底”,下同)进入,热空气从_________进入,理由为_________;
(3)吸收塔应选择耐酸材料,原因是_________;
(4)结晶时,发生反应的离子方程式为_________;
(5)从“氧化”所得含碘卤水中提取碘还可以采用加CCl4的方法,该分离方法为_________;为进一步分离I2和CCl4,向其中加入NaOH溶液与I2反应,生成的I-、IO3-进入水溶液;分液后再酸化,即得粗碘.加入NaOH后溶液中I-、IO3-的物质的量之比为_________;
(6)H2O2也能发生与Cl2类似的反应,若先用H2O2将卤水中的I-氧化为IO3-,再将其与卤水按一定比例混合、酸化制取粗碘,处理含I-为254mg/L的卤水1m3,理论上需20%的H2O2_________g。
【答案】 5Cl2+I2+6H2O=2HIO3+10HCl 塔顶 塔底 (热空气密度小)气体与溶液逆向接触时有利于充分接触、提高吹出率 反应生成HI和H2SO4两种强酸 C12+ 2I-=2Cl-+I2 萃取(或萃取、分液) 5:1 170 g
【解析】试题分析:卤水中碘和氯气发生氧化还原反应生成HCl和HIO3,反应物的接触时间越长,反应越充分,所以含碘卤水应该从塔顶加入,热空气从塔底加入,向剩余液体中加入二氧化硫和水,发生氧化还原反应生成HI和硫酸,再向溶液中通入足量氯气,氯气将HI氧化生成碘单质,最后通过精制得到碘单质。
(1)氯气、碘在水溶液中发生氧化还原反应生成碘酸和HCl,反应方程式为5Cl2+I2+6H2O=2HIO3+10HCl,故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
(2)反应物接触时间越长,反应越充分,热空气密度小,且气体与溶液逆向接触,有利于提高吹出率,所以含碘卤水从塔顶进入,热空气从塔底进入,故答案为:塔顶;塔底;因热空气密度小,且气体与溶液逆向接触,有利于提高吹出率;
(3)碘和二氧化硫在水溶液中能发生氧化还原反应生成HI和H2SO4两种强酸,酸能腐蚀某些物质,所以吸收塔应选择耐酸材料,故答案为:反应生成HI和H2SO4两种强酸;
(4)结晶时,通入氯气,将溶液中的碘离子置换出来,反应的离子方程式为,C12+ 2I-=2Cl-+I2,故答案为:C12+ 2I-=2Cl-+I2;
(5)碘在四氯化碳中的溶解度远远大于在水中的溶解度且碘和四氯化碳不反应,四氯化碳和水不互溶,所以可以采用萃取方法分离;NaOH溶液与I2反应,生成的I-、IO3-进入水溶液,离子反应方程式为6OH-+3I2=5I-+IO3-+3H2O,根据方程式知,加入NaOH后溶液中I-、IO3-的物质的量之比为5:1,故答案为:萃取;5:1;
(6)1m3的254mg/L的卤水中n(I-)=![]() =2mol,H2O2将卤水中的I-氧化为IO3-,发生的反应为3H2O2+I-=3H2O+IO3-①,酸性条件下,I-和碘酸根离子反应方程式为5I-+IO3-+6H+=3I2+3H2O②,
=2mol,H2O2将卤水中的I-氧化为IO3-,发生的反应为3H2O2+I-=3H2O+IO3-①,酸性条件下,I-和碘酸根离子反应方程式为5I-+IO3-+6H+=3I2+3H2O②,
根据方程式②知参加反应的I-和IO3-的关系是5:1,根据I原子守恒得发生反应①消耗I-与生成IO3-关系为1:1,所以反应①中消耗I-的物质的量占总的![]() 为2mol×
为2mol×![]() =
=![]() mol,则消耗n(H2O2)=3×
mol,则消耗n(H2O2)=3×![]() mol=1mol,理论上需20%的H2O2=
mol=1mol,理论上需20%的H2O2=![]() =170g,故答案为:170。
=170g,故答案为:170。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活紧切相关。下列说法正确的是
A.棉花和木材的主要成分都是纤维素,蚕丝和合成纤维的主要成分都是蛋白质
B.石油干馏可得到石油气、汽油、煤油、柴油等
C.从海水中提取物质都必须通过化学反应才能实现
D.纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.55mol·L-1盐酸与50mL0.50mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,尚缺少一种玻璃仪器,这玻璃仪器名称是_________。
(2)烧杯间填满碎纸条的作用是__________________。
(3)若大烧杯上不盖硬纸板,求得的反应热数值___________(填“偏大”“偏小”或“无影响”)。
(4)实验中该用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热 ________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会_______(填“偏大”、“偏小”或“无影响”)。
(6)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差t2-t1分别为2.2℃ 3.5℃ 3.3℃,则最终代入计算式的温差均值为______。已知溶液的比热容4.18J /(g.℃),计算中和热ΔH=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(x)可表示为( )
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(x)可表示为( )
A. v(NH3)=0.010mol/(L·s) B. v(O2)=0.0010mol/(L·s)
C. v(NO)=0.0010 mol/(L·s) D. v(H2O)=0.45 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
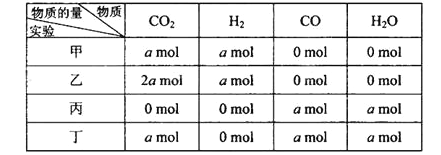
上述四种情况达到平衡后,n(CO)的大小顺序是( )
A. 乙=丁>丙=甲 B. 乙>丁>甲>丙
C. 丁>乙>丙=甲 D. 丁>丙>乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定体积、一定物质的量浓度的溶液,下列操作对实验结果不会产生影响的是( )
A. 容量瓶中原有少量蒸馏水 B. 溶解所用的烧杯未洗涤
C. 定容时仰视观察液面 D. 定容时俯视观察液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列制取氢气的方法中,反应速率最小的是( )
A. 10 ℃时,粉末状锌与3 mol/L硫酸溶液反应
B. 50 ℃时,粉末状锌与3 mol/L硫酸溶液反应
C. 10 ℃时,块状锌与3 mol/L硫酸溶液反应
D. 50 ℃时,块状锌与3 mol/L硫酸溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com