
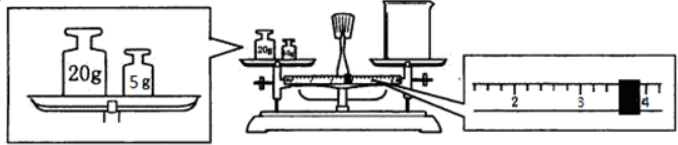
分析 (1)根据n=cv计算溶质Na2CO3的物质的量,利用Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,根据m=nM计算Na2CO3•10H2O的质量;
(2)天平平衡原理为左盘内质量=右盘内质量+游码数值,据此计算.
解答 (1)因配制溶液的体积为240ml,而容量瓶的规格没有240ml,只能选用250ml,Na2CO3的物质的量n=cV=0.25L×1.0mol•L-1=0.25mol,Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,所以Na2CO3•10H2O的质量0.25mol×286g/mol=71.5g,
故答案为:71.5;
(2)天平平衡原理为左盘内质量=右盘内质量+游码数值,所以实际称得烧杯的质量为25g-3.6g=21.4g,
故答案为:21.4.
点评 本题考查了一定物质的量浓度溶液的配制,明确原理及天平的使用方法是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | “山东疫苗案”涉疫苗未冷藏储运而失效,这与蛋白质变性有关 | |
| B. | 硫、氮、碳的氧化物是形成酸雨的主要物质 | |
| C. | 半导体行业中有一句“行话”:“从沙滩到用户”,说明计算机芯片的主要成分是二氧化硅 | |
| D. | 自来水厂常用明矾作消毒杀菌剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 250mL | B. | 375mL | C. | 475mL | D. | 500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 温度 | 0.1mol•L-1Na2S2O3溶液 | 0.1mol•L-1H2SO4溶液 | H2O | 达到相同程度所用的时间/s |
| ① | 25℃ | 25mL | 25mL | 0mL | 4 |
| ② | 25℃ | 25mL | 15mL | 10.0mL | 6 |
| ③ | 25℃ | V1 | 25mL | 10mL | 6 |
| ④ | 45℃ | V2 | 25mL | V3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
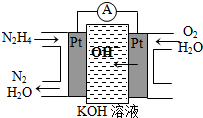 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 | |
| B. | 第二周期元素从Li到F,金属性逐渐减弱,非金属性逐渐增强 | |
| C. | 因为Na比K容易失去电子,所以Na比K的还原性强 | |
| D. | O与S为同主族元素,且O比S的非金属性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com