
在一个容积为2L的密闭容器中,发生如下反应:3X(气)+Y(气)═2Z(气),若最初加入的X、Y和Z都是1mol,反应中X的平均反应速率为0.12mol•L﹣1•s﹣1.若要产物Z为1.8mol,反应所需的时间为()
A. 5s B. 10s C. 15s D. 20s
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列叙述正确的是()
A. 标准状态下,22.4LC4H6中含有碳碳叁键数一定为NA
B. 含1molFeCl3的饱和溶液滴入沸水中得到氢氧化铁胶体粒子数目为NA
C. 在标准状况下,22.4L辛烷中所含分子数为NA
D. 106 g Na2CO3固体中的阴离子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)()
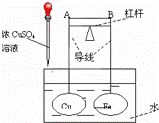
A. 杠杆为导体和绝缘体时,均为A端高,B端低
B. 杠杆为导体和绝缘体时,均为A端低,B端高
C. 当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D. 当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)⇌H2(g)+I2(g).若c(HI)由0.1mol/L 降到0.07mol/L时,需要15s,那么c(HI)由0.07mol/L 降到0.05mol/L时,所需反应的时间为()
A. 等于5 s B. 等于10 s C. 大于10 s D. 小于10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 升高温度能使化学反应速率增大,主要原因是增加了反应物分子 中活化分子的百分数
中活化分子的百分数
B. 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
D. 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
火电厂利用燃煤发电,煤燃烧中的热化学方程式有:C(s)+O2(g)═CO2(g)△H1=﹣393.5kJ/molCO(g)+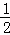 O2(g)═CO2(g)△H2=﹣283kJ/mol C(s)+
O2(g)═CO2(g)△H2=﹣283kJ/mol C(s)+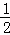 O2(g)═CO(g)△H3=?下列有关说法中不正确的是()
O2(g)═CO(g)△H3=?下列有关说法中不正确的是()
A. CO的燃烧热为283 kJ/mol
B. 二氧化碳分解为一氧化碳和氧气的反应是吸热反应
C. △H3=△H2﹣△H1=110.5 kJ/mol
D. △H3=△H1﹣△H2=﹣110.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)⇌2HI(g)△H<0反应中各物质的浓度随时间变化情况如图1:
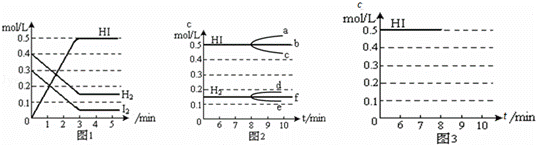
(1)该反应的化学平衡常数表达式为K= .
(2)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K (填写“增大”、“减小”或“不变”)HI浓度的变化正确的是 (用图2中a﹣c的编号回答)
②若加入I2,H2浓度的变化正确的是 ,(用图2中d﹣f的编号回答)
(3)反应达到平衡后,第8分钟时,若反应容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com