
 已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1.8×10-10,且Ksp(AgCl)>Ksp(AgI).如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )
已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1.8×10-10,且Ksp(AgCl)>Ksp(AgI).如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )| A. | 原AgNO3溶液的物质的量浓度为0.1 mol•L-1 | |
| B. | 图中X点的坐标为(10,6) | |
| C. | 图中X点对应溶液中Ag+与Cl-的浓度不相同 | |
| D. | 若把0.1 mol•L-1的NaCl溶液换成0.1 mol•L-1的NaI溶液,则图象在终点后变为虚线部分 |
分析 A.根据pAg=-lg{c(Ag+)}求出Ag+的浓度;
B.x点c(Ag+)=10-6 mol•L-1,根据硝酸银的量求出消耗的氯化钠;
C.x点c(Ag+)=10-6 mol•L-1,结合Ksp计算;
D.由于Ksp(AgI)更小,所以c(Ag+)更小.
解答 解:A.图中原点pAg=0,则Ag+的浓度为:c(Ag+)=100 mol•L-1,即原AgNO3溶液的物质的量浓度为1 mol•L-1,故A错误;
B.x点c(Ag+)=10-6 mol•L-1,一般认为溶液中离子浓度小于10-5 mol•L-1,即沉淀完全,则AgNO3与NaCl恰好反应,n(NaCl)=n(AgNO3)=0.01L×1mol•L-1=0.01mol,所以V(NaCl)=100mL,即x点的坐标为(100,6),故B错误;
C.x点c(Ag+)=10-6 mol•L-1,c(Cl-)=$\frac{1.8×1{0}^{-10}}{1×1{0}^{-6}}$=1.8×10-4 mol•L-1,则Ag+与Cl-的浓度不相同,故C正确;
D.与AgCl相比,碘化银的Ksp(AgI)更小,所以把0.1 mol•L-1的NaCl换成0.1mol•L-1NaI,则溶液中c(Ag+)更小,则pAg更大,图象不符,故D错误;
故选C.
点评 本题考查了AgCl的Ksp的应用,注意把握题干中的信息,考查学生分析题目信息并用于解决问题的能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝、碳酸钠都是常见的胃酸中和剂 | |
| B. | 红葡萄酒密封储存时间越长质量越好原因之一是生成了有香味的酯 | |
| C. | 碘酒中的碘因有还原性而起到杀菌消毒作用 | |
| D. | 食盐、食醋、味精是常用的食品添加剂,其主要成分均属于钠盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水与碳酸氢钠不反应 | |
| B. | 25℃时,0.1mol/L的醋酸溶液与0.01mol/L的醋酸溶液中,Ka前者小于后者 | |
| C. | NaClO溶液中通入少量二氧化碳的反应为:2NaClO+CO2+H2O=Na2CO3+2HClO | |
| D. | 等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH pH(Na2CO3)>pH(NaClO)>pH(CH3COONa) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | WX2分子中所有原子最外层都为8电子结构 | |
| B. | WX2、ZX2均为酸性氧化物 | |
| C. | WX2是以极性键结合成的非极性分子 | |
| D. | 最简单氢化物的稳定性:W>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 6种一溴二甲苯的熔点/℃ | 234 | 206 | 213.8 | 204 | 214.5 | 205 |
| 对应二甲苯的熔点/℃ | 13 | -54 | -27 | -54 | -27 | -54 |
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖和蔗糖互为同分异构体 | |
| B. | 青铜、硬铝和碳素钢都是合金 | |
| C. | 淀粉、蛋白质和花生油都是天然高分子化合物 | |
| D. | 发酵粉中含有小苏打,其主要成分为碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1的FeCl3溶液中,Fe3+离子个数小于NA | |
| B. | Al3+和S2-,NO3-和S2-两组离子在酸、碱和中性溶液中均不能大量共存 | |
| C. | Ca(HCO3)2溶液与过量NaOH溶液反应的离子方程式:Ca2++HCO3-+OH-=CaCO3↓+2H2O | |
| D. | 向10 mL 0.1 mol•L-1 CH3COONa溶液中加入5 mL 0.1 mol•L-1盐酸时,溶液中c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酯水解试验中,可以通过观察酯层消失的时间差异,来判断乙酸乙酯在不同条件下水解速率的差别 | |
| B. | 探究“温度影响硫代硫酸钠与稀硫酸反应速率的因素”的实验中,需要用到的计量仪器只需量筒、温度计 | |
| C. | 在溴富集过程中,可在分液漏斗中加入4mL溴水,再向其中加入10mL四氯化碳,振荡,静置、分液,得下层液体 | |
| D. | 实验室制备乙烯常用硫酸铜溶液洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
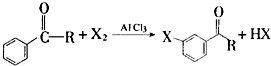


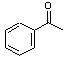 +Br2$\stackrel{AlCl_{3}}{→}$
+Br2$\stackrel{AlCl_{3}}{→}$ +HBr
+HBr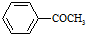 的符合以下条件的同分异构体还有4种(不包括原料本身),条件:结构中必须含有苯环和
的符合以下条件的同分异构体还有4种(不包括原料本身),条件:结构中必须含有苯环和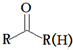 ,其中核磁共振氢谱图中共有5个吸收峰的分子的结构简式为
,其中核磁共振氢谱图中共有5个吸收峰的分子的结构简式为
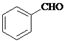 )和乙醇为原料合成苯乙酸乙酯,如图
)和乙醇为原料合成苯乙酸乙酯,如图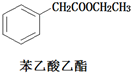 :
:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com