
【题目】已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸 | 氢硫酸 | 氢氰酸 |
Ka=1.8×10-5 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=4.9×10-10 |
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为_____________(填序号)。
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为 _____________(填序号)。
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是_______。
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为___________________。
【答案】b>a>c ②>①>③ ③>②>① ac CN-+H2S=HS-+HCN
【解析】
(1)体积相同、c(H+)相同的三种酸溶液,电离常数越小,起始浓度越大,而中和碱的能力,需使用酸的起始浓度。
(2)25℃时,等浓度的三种溶液,对应酸的酸性越弱,水解能力越强,溶液的pH越大。
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,从水解方程式和水的电离方程式两方面分析阴离子总浓度关系。
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,溶质为等浓度的HCN和NaCN,混合溶液中c(Na+)>c(CN-),则根据电荷守恒,c(H+)<c(OH-)。
a.由以上分析可知,c(H+)<c(OH-),a正确;
b.溶液中,溶质为等浓度的HCN和NaCN,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+ c(CN-),物料守恒:c(HCN)+c(CN-)=2c(Na+),则c(HCN)- c(CN-)=2[c(OH-)- c(H+)],b错误;
c.反应后的溶液中,根据物料守恒,c(HCN)+c(CN-)=0.01mol/L,c正确。
(5)25℃时,向NaCN溶液中通入少量H2S,因为氢硫酸的Ka2小于氢氰酸的Ka,则HS-与CN-不能发生反应,由此可得出反应的离子方程式。
(1)体积相同、c(H+)相同的三种酸溶液,电离常数越小,起始浓度越大,而中和碱的能力,酸的起始浓度越大,消耗碱的体积越大。醋酸的Ka=1.8×10-5,氢硫酸的Ka1=9.1×10-8,氢氰酸的Ka=4.9×10-10,则消耗NaOH溶液的体积由大到小的排列顺序是b>a>c。答案为:b>a>c;
(2)25℃时,等浓度的三种溶液,对应酸的酸性越弱,水解能力越强,溶液的pH越大。三种酸的酸性:醋酸>氢硫酸>氢氰酸,pH由大到小的顺序为②>①>③。答案为:②>①>③;
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,从水解方程式和水的电离方程式两方面分析阴离子总浓度关系。CN-+H2O![]() HCN+OH-,CH3COO-+H2O
HCN+OH-,CH3COO-+H2O![]() CH3COOH+OH-,Cl-不发生水解,此时三份溶液中的阴离子总浓度相等。在三份溶液中,H2O
CH3COOH+OH-,Cl-不发生水解,此时三份溶液中的阴离子总浓度相等。在三份溶液中,H2O![]() H++OH-,水解后的溶液中,c(OH-)越大,水的电离程度越小,最终溶液中阴离子的总浓度越小,故阴离子总浓度由大到小的顺序为③>②>①。答案为:③>②>①;
H++OH-,水解后的溶液中,c(OH-)越大,水的电离程度越小,最终溶液中阴离子的总浓度越小,故阴离子总浓度由大到小的顺序为③>②>①。答案为:③>②>①;
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,溶质为等浓度的HCN和NaCN,混合溶液中c(Na+)>c(CN-),则根据电荷守恒,c(H+)<c(OH-)。
a.由以上分析可知,c(H+)<c(OH-),a正确;
b.溶液中,溶质为等浓度的HCN和NaCN,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+ c(CN-),物料守恒:c(HCN)+c(CN-)=2c(Na+),则c(HCN)- c(CN-)=2[c(OH-)- c(H+)],b错误;
c.反应后的溶液中,根据物料守恒,c(HCN)+c(CN-)=0.01mol/L,c正确。
答案为:ac;
(5)25℃时,向NaCN溶液中通入少量H2S,因为氢硫酸的Ka2小于氢氰酸的Ka,则HS-与CN-不能发生反应,由此可得出反应的离子方程式为CN-+H2S=HS-+HCN。答案为:CN-+H2S=HS-+HCN。


科目:高中化学 来源: 题型:
【题目】工业上利用硫黄生产硫酸的步骤及反应为:
①造气: ;
;
②催化氧化:![]() ;
;
③吸收:![]() 。
。
(1)根据图1写出![]() 与
与![]() 反应生成
反应生成![]() 的热化学方程式: ______ 。
的热化学方程式: ______ 。

(2)某温度下![]() ;
;![]() 。开始时在10L的密闭容器中加入
。开始时在10L的密闭容器中加入![]() 和
和![]() ,当反应达到平衡时共放出热量196kJ,求该温度下
,当反应达到平衡时共放出热量196kJ,求该温度下![]() 平衡常数K=______ 。
平衡常数K=______ 。
(3)某人设想以图2所示装置用电化学原理生产硫酸,写出通入![]() 的电极的电极反应式: ______ 。
的电极的电极反应式: ______ 。
(4)有两只密闭容器A和B,A容器有一移动的活塞能使容器内保持恒压,B容器能保持恒容,起始向这两只容器中分别充入等量的体积比为2:1的![]() 和
和![]() 的混合气体,并使A和B容积相等
的混合气体,并使A和B容积相等![]() 如图
如图![]() ,
,![]() 时发生如下反应:
时发生如下反应:![]() 填写下列空格:
填写下列空格:
①![]() 容器中
容器中![]() 的转化率比B容器 ______
的转化率比B容器 ______
②达到![]() 所述平衡后,若向两容器通入等量的原反应气体,达到平衡时A容器中
所述平衡后,若向两容器通入等量的原反应气体,达到平衡时A容器中![]() 的体积分数 ______
的体积分数 ______ ![]() 增大、减小、不变
增大、减小、不变![]() ,B容器中
,B容器中![]() 的体积分数 ______
的体积分数 ______ ![]() 增大、减小、不变
增大、减小、不变![]()
(5)对于反应![]() ,一定条件下达到平衡后,在保证O2浓度不变的情况下,增大容器的体积,试根据平衡常数,判断平衡 ______
,一定条件下达到平衡后,在保证O2浓度不变的情况下,增大容器的体积,试根据平衡常数,判断平衡 ______ ![]() 填“正向移动”、“逆向移动”或“不移动”
填“正向移动”、“逆向移动”或“不移动”![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下:
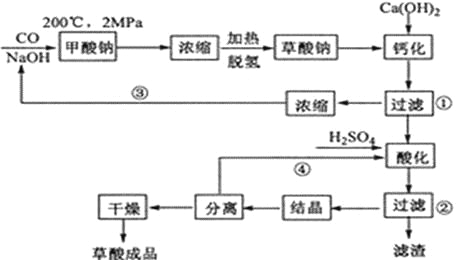
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为______________________________、_______________________________________。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是_______,滤渣是_______;过滤操作②的滤液是__________和___________,滤渣是______________。
(3)工艺过程中③和④的目的是____________________________________。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是_____________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水中,用0.0500 mol·L-1的酸性KMnO4溶液滴定,至粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为__________________________;列式计算该成品的纯度________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
铬、锰、铁、钴、镍等过渡金属元索的单质及其化合物在工农业、国防、科技等领域具存广泛应用。
(1)基态Cr原子中有_________个未成对电子,最外层电子所占用能级的电子云形状为_______。
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关,一般地,为d0或d10排布时,无颜色;为d1d9排布时,有颜色。则:[Mn(H2O)6]2+ ________(填“无”或“有”)颜色。
(3)不同温度下,铁单质晶胞的两种堆积方式如图所示

①图1和图2中Fe原子的配位数分别为_______________和________________。
②若图2的晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞中两个最近的Fe原子之间的距离为__________pm。(用含ρ、NA的代数式表示)
(4)已知MgO与NiO的晶体结构(如图3)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO__________NiO(填“>”“<”或“=”),理由是_______________。若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图4),已知O2-的半径为ɑ m,每平方米面积上分散的该晶体的质量为_________g。(用含ɑ、NA的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用燃烧法确定有机物的组成。这种方法是在电炉加热时用纯氧氧化管内样品,根据产物质量确定有机物的组成,装置如下图所示,是用燃烧法确定有机物化学式常用的装置。产生的氧气按从左到右流向各导管的连接顺序为g-f,e-h , i-c , d-a。

回答下列问题:
(1)C装置中浓H2SO4的作用______________________________________。
(2)D装置中MnO2的作用为________________________。
(3)E中CuO的作用为_____________________。
(4)若准确称取0.90 g样品(只含C、H、O三种元素中的两种或三种)经充分燃烧后,A管质量增加1.32 g,B管质量增加0.54 g,则该有机物最简式为______________,若此有机物的相对分子质量为90,则其分子式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃ 时,向体积均为20mL、浓度均为0.1000mol·L-1的三种酸HX、HY、HZ溶液中分别逐滴加入0.1000mol·L-1的NaOH溶液,所得溶液的pH与加入NaOH溶液的体积关系如图所示。下列说法正确的是( )
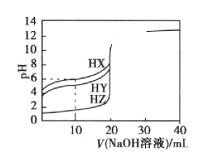
A.当V(NaOH溶液)=0mL时,三种溶液相比较c(X-)>c(Y-)>c(Z-)
B.当三种溶液pH均等于7时,反应消耗的n(HX)>n(HY)>n(HZ)
C.当V(NaOH溶液)=10mL时,反应后溶液中各离子浓度由大到小的顺序为c(X-)>c(Y-)>c(Z-)>c(Na+)
D.HY与HZ混合溶液中:c(H+)=c(Y-)+c(Z-)+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,向容积为2L的恒容密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H= —41kJ·mol-1。数据如下,下列说法错误的是( )
CO2(g)+H2(g) △H= —41kJ·mol-1。数据如下,下列说法错误的是( )
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A.乙容器中,平衡时,反应放出的热量为32.8kJB.T1时,反应的平衡常数K乙=1
C.平衡时,乙中CO的浓度是甲中的2倍D.乙容器中,平衡时H2O的转化率约为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 实验室欲用NaOH固体配制
实验室欲用NaOH固体配制![]() 的NaOH溶液
的NaOH溶液![]() 。
。
①本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、250mL容量瓶、还有_________;
②要完成本实验该同学应称出____________![]() ;
;
③若直接在天平的两个托盘上放两张质量相等的纸片进行称量,则会使得配制结果_______。![]() 偏低、偏高或无影响
偏低、偏高或无影响![]()
![]() 铁不能与冷、热水反应,但能与水蒸气反应。老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。
铁不能与冷、热水反应,但能与水蒸气反应。老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。

①反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当_________时![]() 填实验现象
填实验现象![]() ,说明“铁与水蒸气”能够进行反应;
,说明“铁与水蒸气”能够进行反应;
②写出该反应的化学方程式,并用单线桥表示出电子转移情况___________;
③为了研究一定时间内铁粉的消耗量,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积![]() 已折算成标准状况
已折算成标准状况![]() 。收集并测量气体体积应选下图中的________装置;
。收集并测量气体体积应选下图中的________装置;

若称取![]() 铁粉,然后与水蒸气加热至无气体放出,最好选用__________规格的量筒
铁粉,然后与水蒸气加热至无气体放出,最好选用__________规格的量筒![]() 选填字母序号
选填字母序号![]() 。
。
A.100mL B.200mL C.500mL D.1000mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com