

分析 (1)排气法收集气体考虑气体的密度;(2)①铜与浓硫酸的反应:; ②氧化还原反应中失电子元素所在物质做还原剂; ③硫酸根离子用钡离子检验,生成白色沉淀.
解答 解(1)本实验收集气体为二氧化硫,二氧化硫溶于水,选择排空气法,气体密度与相对质量成正比,二氧化硫的相对分子质量为64,比空气的平均相对分子质量29大,所以进气管应伸入集气瓶底部,出气管在集气瓶口部.故答案为: ;(2)①铜与浓硫酸的反应为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O; ②反应中 失去电子成铜离子,失电子做还原剂,所以铜作还原剂.故答案为:还原剂; ③硫酸根离子结合钡离子生成不溶于酸的白色沉淀硫酸钡. 故答案为:D.
;(2)①铜与浓硫酸的反应为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O; ②反应中 失去电子成铜离子,失电子做还原剂,所以铜作还原剂.故答案为:还原剂; ③硫酸根离子结合钡离子生成不溶于酸的白色沉淀硫酸钡. 故答案为:D.
点评 本题考查铜与浓硫酸的反应,气体的收集,氧化还原反应还原剂的判断,以及离子检验.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:选择题
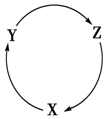 下列各组物质中,满足图中物质一步转化关系的选项是( )
下列各组物质中,满足图中物质一步转化关系的选项是( )| X | Y | Z | |
| A | CO | CO2 | H2CO3 |
| B | Cu | CuO | Cu(OH)2 |
| C | CaO | Ca(OH)2 | CaCO3 |
| D | H2SO4 | Na2SO4 | NaCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | CO2的水溶液能导电,所以CO2为电解质 | |
| C. | 可使用丁达尔效应来区分FeCl3溶液和Fe(OH)3胶体 | |
| D. | 1 mol 任何物质均含有约6.02×1023个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 沸点/℃ | 密度/g•cm-3 | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
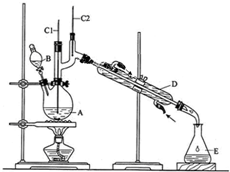
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:| 相对分子质量 | 密度/(g•cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com