
| 物质 | FeS | MnS | CuS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 |
| 物质 | PbS | HgS | ZnS |
| Ksp | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
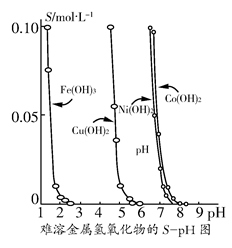
 Cu2+(aq)+2OH-(aq),加入氨水后生成难电离的[Cu(NH3)4]2+,促进Cu(OH)2的溶解。
Cu2+(aq)+2OH-(aq),加入氨水后生成难电离的[Cu(NH3)4]2+,促进Cu(OH)2的溶解。

科目:高中化学 来源:不详 题型:单选题
| A.用SO2漂白纸浆和草帽辫 |
| B.用硫酸清洗锅炉中的水垢 |
| C.高温下用焦炭还原SiO2制取粗硅 |
| D.用 Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Mg(OH)2的溶度积大于MgCO3的溶度积,且在水中发生了沉淀转化 |
| B.Mg(OH)2比MgCO3更难溶,且在水中发生了沉淀转化 |
C.MgCO3电离出的CO 发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀 发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀 |
D.MgCO3电离出的CO 发生水解,促进水中OH-浓度增大,对Mg(OH)2沉淀溶解平衡而言,Qc>Ksp,生成Mg(OH)2沉淀 发生水解,促进水中OH-浓度增大,对Mg(OH)2沉淀溶解平衡而言,Qc>Ksp,生成Mg(OH)2沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4) |
| B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替 |
| C.若误饮c(Ba2+)=1.0×10-5 mol/L的溶液时,会引起钡离子中毒 |
| D.可以用0.36 mol/L的Na2SO4溶液给钡离子中毒患者洗胃 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
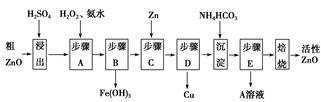
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
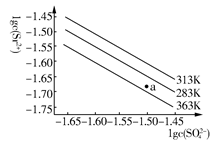
| A.温度一定时,Ksp(SrSO4)随c(SO42—)的增大而减小 |
| B.三个不同温度中,313 K时Ksp(SrSO4)最大 |
| C.283 K时,图中a点对应的溶液是饱和溶液 |
| D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuS<Cu(OH)2<CuCO3 | B.CuS>Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS | D.Cu(OH)2<CuCO3<CuS |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
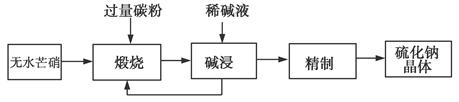
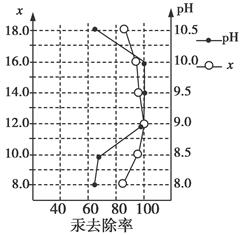
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由于Ksp(BaSO4)=" 1.1" ×10-10 小于Ksp(BaCO3)=" 5.1" ×10-9,则不能使BaSO4沉淀转化为BaCO3沉淀 |
| B.在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的最高温度作为末温度 |
| C.除去CH3COOC2H5中的CH3COOH先加足量的饱和Na2CO3溶液再蒸馏 |
| D.能使湿润的KI淀粉试纸变蓝的气体一定是Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com