
| A. | 1:3:6 | B. | 2:1:6 | C. | 3:5:12 | D. | 1:1:6 |
分析 HCHO燃烧生成二氧化碳与水,氢气燃烧生成水,反应方程式为HCHO+O2$\frac{\underline{\;点燃\;}}{\;}$CO2+H2O,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,二氧化碳、水与过氧化钠反应:2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,通过方程式可以看出,固体质量的增加量就是原混合气体中HCHO、H2的质量和,据此计算.
解答 解:HCHO燃烧生成二氧化碳与水,氢气燃烧生成水,反应方程式为HCHO+O2$\frac{\underline{\;点燃\;}}{\;}$CO2+H2O,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,二氧化碳、水与过氧化钠反应2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,
通过方程式可以看出,固体质量的增加量就是原混合气体中HCHO、H2的质量和,
Na2O2增重8g,所以HCHO、H2的质量和为8g,
所以混合气体中氧气的质量为20g-8g=12g,
所以氧气的质量分数为$\frac{12g}{20g}$×100%=60%,
A.W(O2)=$\frac{6}{1+3+6}×100%=60%$,故A正确;
B.W(O2)=$\frac{6}{2+1+6}×100%$=66.7%,故B错误;
C.W(O2)=$\frac{12}{3+5+12}×100%$=60%,故C正确;
D.W(O2)=$\frac{6}{1+1+6}$×100%=75%,故D错误;
故选AC.
点评 本题考查混合物的计算,题目难度中等,关键在于根据反应方程式判断过氧化钠固体质量增加实质为氢气与甲醛的质量.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属元素的原子只有还原性,其阳离子只有氧化性 | |
| B. | O2与O3互为同位素,相互转化为化学变化 | |
| C. | 1H 2H 3H互为同位素,其性质相似 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质(杂质) | 所用试剂 | 分离方法 |
| A | 甲烷(乙烯) | 溴水 | 洗气 |
| B | 氢氧化钠溶液(氢氧化钙溶液) | 二氧化碳 | 过滤 |
| C | 乙烯(SO2) | 酸性KMnO4 | 洗气 |
| D | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44gCO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L0.5mol•L-1亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 0.5molCH5+中含有的电子数目为5NA | |
| D. | 常温下,1L0.5mol•L-1Ba(OH)2溶液中水电离的OH-个数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
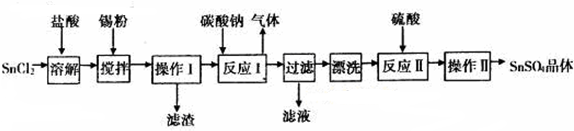
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥⑦ | B. | ①⑤⑥ | C. | ②③⑤ | D. | ④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO中少量O2:通过灼热的Cu网后收集气体 | |
| B. | 除去K2CO3中少量NaHCO3:置于坩埚中加热 | |
| C. | 除去N2中少量NH3,可依次通过水、浓H2SO4洗后收集气体 | |
| D. | 可用铁粉除去FeCl3溶液中的少量的CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该稀硝酸中HNO3的物质的量浓度是4.0mol/L | |
| B. | 加入NaOH溶液的体积是560mL | |
| C. | 被还原的硝酸的物质的量为0.04mol | |
| D. | 得到的金属氢氧化物的沉淀为5.81克 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com