

分析 方案一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(1)镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢氧化钠溶液的体积应大于或等于最大值,据此计算;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大;
方案二:(1)①装置的组装顺序:合金与水反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部;
②镁、铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大;
③反应放热导致氢气的温度偏高,故应冷却后再进行读取氢气的体积,读取实验中生成氢气的体积时上下移动量筒,使其中液面与广口瓶中液面相平,视线与凹液面的最低点水平读取氢气的体积;
解答 解:方案一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(1)含镁为3%时,金属铝的含量最高,5.4g合金中铝的质量为,5.4g×(1-3%)=5.4×97%g,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g 2mol
5.4g×97%g V×10-3L×2.0mol/L
所以54g:(5.4g×97%g)=2mol:(V×10-3L×2.0mol/L),解得:V=97,故V(NaOH溶液)≥97mL;
故答案为:97ml;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏高;
故答案为:偏高;
方案二:(1)①装置的组装顺序:合金与水反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:(A)接(E)(D)接(G);
故答案为:E、D、G;
②镁、铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大,导致硫酸不能顺利滴入锥形瓶;
故答案为:镁铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大;
③反应放热导致氢气的温度偏高,故应冷却后再进行读取氢气的体积,读取实验中生成氢气的体积时上下移动量筒,使其中液面与广口瓶中液面相平,视线与凹液面的最低点水平读取氢气的体积;
故选ACD.
点评 本题主要考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:推断题

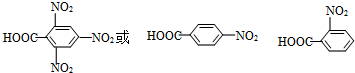 (其中一种)(写结构简式,一种即可).
(其中一种)(写结构简式,一种即可). +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl
+NaCl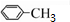 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl;反应④是取代反应 (填反应类型).
+HCl;反应④是取代反应 (填反应类型).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
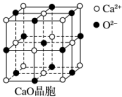 可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.
可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.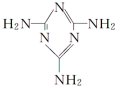 )俗称“蛋白精”,三聚氰酸(
)俗称“蛋白精”,三聚氰酸( 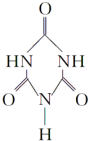 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | Na2O、NaOH、Na2CO3、NaCl、Na2SO4、Na2O2都属于钠的含氧化合物 | |
| C. | 漂白粉、福尔马林、冰水、王水、氯水均为混合物 | |
| D. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
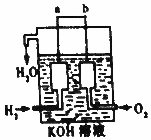 氢气被公认是21世纪替代矿物燃料的理想能源.请回答下列问题
氢气被公认是21世纪替代矿物燃料的理想能源.请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CN-可以和稀硫酸反应生成HCN | B. | CN-可被Cl2氧化成(CN)2 | ||
| C. | 在水溶液中(CN)2不能将F-氧化 | D. | HCN的电子式为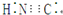 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH2与HCl加成 | |
| B. | CH3-CH2-CHOH-CH3在浓硫酸存在下,发生分子内脱水 | |
| C. | C6H5-CH3在铁粉存在下与氯气反应 | |
| D. | CH3-CHCl-CH3与氢氧化钠醇溶液共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤①中发生的主要反应为Cl2+2Br-═Br2+2Cl- | |
| B. | 步骤②③的目的是富集溴元素 | |
| C. | 物质X 为HBrO | |
| D. | 空气吹出法用到了溴易挥发的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 12 | C. | 18 | D. | 24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com