
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“Cu+2Ag+ =2 Ag +Cu2+ ”,设制一个化学电池(正极材料用碳棒),回答下列问题:
①该电池的负极材料是_______,电解质溶液是_____________;
②正极的反应式为_____________________.
③若导线上转移电子1mol,则生成银___________克.
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
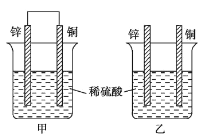
①在相同时间内,两烧杯中产生气泡的速度:甲____________乙(填“>”、“<“或“=” ).
②请写出图中构成原电池的负极电极反应式_______________. 电池工作时,溶液中SO42-向______极(填正、负)移动,电池工作完成后,溶液中SO42-浓度_________(填增大或减小或不变).
【答案】铜(或Cu) 硝酸银(或AgNO3)溶液 Ag++e-=Ag 108 > Zn -2e-= Zn2+ 负 不变
【解析】
原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,结合相关物质的性质、原电池的组成分析解答。
(1)①根据方程式Cu+2Ag+ =2Ag+Cu2+可知铜失去电子,银离子得到电子,所以该电池的负极材料是铜,电解质溶液是含有银离子的可溶性盐,可以为硝酸银(或AgNO3)溶液;
②正极银离子得到电子,电极反应式为Ag++e-=Ag;
③若导线上转移电子1mol,则根据反应式Ag++e-=Ag可知生成银1mol,质量是108g;
(2)①根据装置图可知甲中构成原电池,锌是负极,铜是正极,乙中不能构成原电池,铜与稀硫酸不反应,锌和稀硫酸发生置换反应,所以在相同时间内,两烧杯中产生气泡的速度:甲>乙;
②甲中构成原电池,锌是负极,则负极电极反应式为Zn-2e-=Zn2+;电池工作时,溶液中阴离子SO42-向负极移动,由于硫酸根离子不参与电极反应,则电池工作完成后,溶液中SO42-浓度不变。


科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuC1)在化工、印染、电镀等行业应用广泛。CuCl微溶于水,不溶于醇和稀酸,可溶于Cl-浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuC1的工艺过程如图所示:

回答下列问题:
(1)步骤①中N元素被还原为最低价,写出此反应的离子方程式___________。
(2)步骤②中,亚硫酸铵要略保持过量,原因是___________,滤液中可循环利用的物质是___________。
(3)步骤⑤中,醇洗的目的是______________________。
(4)常用K2Cr2O7溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品10.00g,将其置于过量的FeCl2溶液中,待样品完全溶解后,加入适量稀硫酸配成100mL溶液,取溶液10.00mL用0.1000mol·L K2Cr2O7溶液进行滴定,反应中Cr2O72-被还原成Cr3+,相关数据记录如下表所示:
实验编号 | 1 | 2 | 3 |
消耗K2Cr2O7溶液的体积/mL | 14.98 | 16.03 | 15.02 |
该样品中CuCl的质量分数___________。(保留4位有效数字)
(5)制造印刷电路板产生的废液中含大量[Cu(NH3)4]2+等离子,利用膜电解技术对此废液进行电解,电解装置如下图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到CuCl,电解时阴极的电极反应式为___________,生成CuCl的离子方程式为______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. pH值小于7的雨水称为酸雨B. 工厂将烟囱造高能减小对环境的污染
C. 全球气温变暖是因为SO2的大量排放D. 油电混动车的大量推广可减轻环境的污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子反应方程式为( )
A. Ba(OH)2溶液中加入少量NaHCO3溶液:HCO3-+Ba2++OH-=BaCO3![]() +H2O
+H2O
B. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:3Ba2++3SO42-+2Al3++6OH-═2BaSO4↓+2Al(OH)3↓
C. NH4HCO3稀溶液与过量的KOH溶液反应:HCO3-+OH-=CO32-+H2O
D. 醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将AgCl分别加入盛有:①5 mL水;② 6 mL0.5mol·L-1 NaCl溶液;③10 mL0.2mol·L-1 CaCl2溶液;④50 mL0.1mol·L-1盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是
A. ④③②① B. ②③④① C. ①④③② D. ①③②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃的单体甲基丙烯酸甲酯(MMA) 的合成原理如下:
 (MMA)
(MMA)
下列说法正确的是
A. 若反应①的原子利用率为100%,则物质X为CO2
B. 可用分液漏斗分离MMA和甲醇
C. ![]() 、
、![]() 均可发生加成反应、氧化反应、取代反应
均可发生加成反应、氧化反应、取代反应
D. MMA与H2反应生成Y,能与NaHCO3溶液反应的Y的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某镍冶炼车间排放的漂洗废水中含有一定浓度的Ni2+和Cl-,图甲是双膜三室电沉积法回收废水中Ni2+的示意图,图乙描述的是实验中阴极液pH与镍回收率之间的关系。下列说法不正确的是

A. 交换膜b为阴离子交换膜
B. 阳极反应式为2H2O-4e-=O2↑+4H+
C. 阴极液pH= 1时,镍的回收率低主要是有较多H2生成
D. 浓缩室得到1L 0.5 mol/L盐酸时,阴极回收得到11.8 g镍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com