
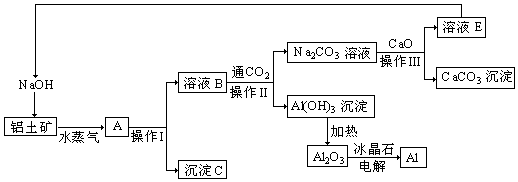
���� ���������������������������������м���NaOH��Һ��������ӦAl2O3+2OH-�T2AlO2-+H2O��������������NaOH��Һ��Ȼ����ˣ��õ���ҺBΪNaOH��NaAlO2�����Һ������CΪFe2O3������ҺB��ͨ��CO2��������Ӧ2AlO2-+CO2+3H2O=2Al��OH��3��+CO32-��2OH-+CO2=CO32-+H2O��Ȼ����˵õ�����Al��OH��3��Na2CO3��Һ������Һ�м���CaO��������ӦNa2CO3+CaO+H2O�T2NaOH+CaCO3����Ȼ����ˣ���NaOHѭ�����ã���Al��OH��3���ȵõ�Al2O3���������Al2O3�õ�Al���ݴ˴��⣻
��� �⣺��1����������ķ�����֪���������м���NaOH��Һ�����������������Ʒ�Ӧ����ƫ�����ƣ���Ӧ�Ļ�ѧ����ʽΪAl2O3+2NaOH�T2NaAlO2+H2O��
�ʴ�Ϊ��Al2O3+2NaOH�T2NaAlO2+H2O��
��2������CΪFe2O3��Ϊ����ɫ���׳����죬�������ڽ���ұ�����⣬����������ϣ�
�ʴ�Ϊ������ɫ�����ϣ�����������
��3��ʵ�ֹ����Һ��ķ�����ù��˷�������������Ͳ������ǹ��˲���������ʱ��Ҫ������������©�����̶�����������̨�������õIJ��������н���Һ���ձ���
�ʴ�Ϊ���ձ���©������������
��4��ϴ��Al��OH��3����Ӧ�ò�����������������м�ˮ��ûAl��OH��3��������ȥϴҺ����2��3�μ��ɣ�
�ʴ�Ϊ���ò�����������������м�ˮ��û��������ȥϴҺ����2��3�μ��ɣ�
��5������̼��Ƶõ�CaO��CO2��B���ɳ�����Ҫ������̼��̼����ת��Ϊ̼�����ҪCaO������CaO��CO2��ѭ�����ã����������õ�Fe2O3�͵������Al2O3�õ���O2Ϊ����Ʒ��
�ʴ�Ϊ��CaO��CO2��Fe2O3��O2��
���� ���⿼�����ʷ�����ᴿ�����ؿ���ѧ��������֪ʶ������������ȷ�������ʼ�����������������Ӧԭ�����ɽ��֪������Ԫ�ػ�����֪ʶ���������Ӽ��鷽������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 12C��14CΪ��ͬ���� | B�� | ʯī��C60��Ϊͬ�������� | ||
| C�� | H2O��D2O��Ϊͬλ�� | D�� | ${\;}_{17}^{35}$X��${\;}_{17}^{37}$Y Ϊͬ��Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������������֮��Ϊ136 | |
| B�� | �Ԫ��λ��Ԫ�����ڱ��е������ڢ��� | |
| C�� | ����ķ���ʽΪRn2 | |
| D�� | �Ԫ�������ȶ�������������Ԫ�ػ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ݷ�Ӧ�е������仯������ѧ��Ӧ��Ϊ�����ϡ��ֽ⡢���ֽ⡢�û������� | |
| B�� | ������Һ��������ǿ����������ʷ�Ϊǿ����ʡ�������� | |
| C�� | ���ݷ�ɢ�����ӵĴ�С������ɢϵ��Ϊ��Һ����Һ�ͽ��� | |
| D�� | ���ݴ������Ԫ����ɣ����������Ϊ���ʺͻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaOH=Na++OH- | B�� | Na2SO4=2Na++SO4-2 | ||
| C�� | H2SO4=H2++SO42- | D�� | Ca��NO3��2=Ca2++2��NO3��2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������ѹǿ��� | B�� | O2��O3��ԭ�Ӹ������ | ||
| C�� | �������������������ͬ | D�� | ��������ķ�����Ŀ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com