
| A. | 0.5 mol•L-1 | B. | 2 mol•L-1 | C. | 4 mol•L-1 | D. | 5 mol•L-1 |
分析 NH4I分解生成的HI为平衡时HI与分解的HI之和,即为NH4I分解生成的NH3,由反应②可知分解的c(HI)为平衡时c(H2)的2倍,由反应③可知c(NH3)为c(N2)的2倍,①分解生成的NH3为平衡时NH3与分解的NH3之和,以此来解答.
解答 解:c(N2)=0.5mol/L,由③可知,分解的氨气为0.5mol/L×2=1mol/L,生成的氢气为1.5mol/L,
c(H2)=2mol/L,由2HI(g)?H2(g)+I2(g)可知,HI分解生成的H2的浓度为0.5mol•L-1,则:
平衡时c(HI)=4mol•L-1,NH4I分解生成的HI的浓度为4mol•L-1+2×0.5mol•L-1=5mol•L-1,
由①可知NH4I分解生成的NH3的浓度为5mol•L-1,
则平衡时 NH3的浓度为5mol/L-1mol/L=4mol/L,
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握反应②③均生成氢气、氨气的平衡浓度等于①与③中氨气浓度之差为解答的关键,侧重分析与计算能力的考查,注意反应的叠加增大了试题的难度,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在城区内汽车限行,限制燃煤锅炉的使用 | |
| B. | 容易产生扬尘的工厂和建筑工地停工 | |
| C. | 在灰尘较多的道路洒水,以减少扬尘的产生 | |
| D. | 要求市民出行时一定要戴防雾霾专用口罩 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质编号 | 所属类别编号 | 物质编号 | 所属类别编号 |
| (1) | (4) | ||
| (2) | (5) | ||
| (3) | (6) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3O2(g)=2O3(g)△H>0,则可判定O2(g)比O3(g)稳定 | |
| B. | 由1 mol H2形成2 mol H要放出热量 | |
| C. | 500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)反应生成NH3(g)放热Q kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-2Q kJ/mol | |
| D. | 已知Ni(CO)4(g)=Ni(s)+4CO(g)△H=Q kJ/mol,则Ni(s)+4CO(g)=Ni(CO)4(g)△H=-Q kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
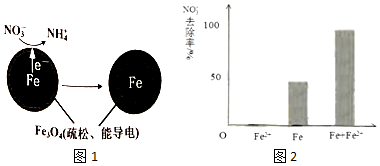
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH中氢是+1价 | |
| B. | NaH中阴离子半径比锂离子半径小 | |
| C. | NaH中阴离子的电子层排布与氦原子相同 | |
| D. | NaH中阴离子可被还原成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质的量/mol 时间 | n(N2H4) | N(NO2) | N(N2) |
| 起始 | 2.0 | 3.0 | 0 |
| 第2min | 1.5 | a | 0.75 |
| 第4min | 1.2 | b | 1.2 |
| 第6min | 1.0 | c | 1.5 |
| 第7min | 1.0 | c | 1.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com