
【题目】对室温下100mL pH=2的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( ) 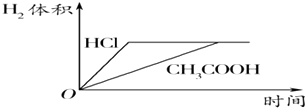
A.加水稀释至溶液体积为200mL,醋酸溶液的pH变为4
B.温度都升高20°C后,两溶液的pH不再相等
C.加水稀释至溶液体积为200mL后,两种溶液中c(OH﹣)都减小
D.加足量的锌充分反应后,两溶液中产生的氢气体积可用上图表示
【答案】B
【解析】解:A、对于酸,加水稀释后,溶液的酸性均要减弱,两溶液的pH均增大,稀释至200ml,溶液的浓度变为原来的一半,pH变化小于1个单位,则醋酸溶液的pH<3,故A错误;
B、盐酸是强酸,完全电离,醋酸是弱酸,部分电离,升高温度,醋酸的电离程度增大,所以酸性会增强,pH会减小,则两溶液的pH不再相等,故B正确;
C、对于酸,加水稀释后,溶液的酸性均要减弱,两溶液的pH均增大,则两种溶液中c(OH﹣)都增大,故C错误;
D、盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,相同体积的两种溶液,加足量的锌充分反应后,醋酸产生的氢气比盐酸多,故D错误.
故选B.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】关于1 mol/L K2SO4溶液的下列说法正确的是( )
A.溶液中含有1mol K2SO4 B.1molK2SO4溶于1L水中
C.溶液中c(K+ )=2mol/L D.1L 溶液中含2molK+,2molSO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题.
(1)根据图1回答①②: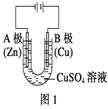
①A电极可观察到的现象是 , 电极反应式为;B极的电极反应式为 .
②通电一段时间后,CuSO4溶液的浓度 , pH(填“变大”、“变小”或“不变”).
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为 , 电解反应的离子方程式为 .
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列微粒中,未成对电子数最多的是( )
A.C:1s22s22p2
B.S:1s22s22p63s23p4
C.Cr:1s22s22p63s23p63d54s1
D.Fe:1s22s22p63s23p63d64s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一可逆反应2A(g)+3B(g)4C(g)+D(g),已知起始浓度c(A)=2mol/L,c(B)=3mol/L,c(C)=c(D)=0,反应开始20min后达到平衡状态,此时D的平衡浓度为0.5mol/L,则下列说法不正确的是( )
A.前20 min的平均反应速率v(C)=0.1 mol/(Lmin)
B.A的转化率为50%
C.C的平衡浓度c(C)=4 mol/L
D.B的平衡浓度c(B)=1.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠及其化合物的叙述,正确的是( )
A. 发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔
B. 氧化钠可作为呼吸面具中的氧气来源
C. 碳酸钠的水溶液呈中性
D. 硫酸钠灼烧时火焰呈紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠的氧化物的叙述正确的是( )
A. Na2O2是白色固体,和冷水反应得到O2和NaOH
B. Na2O2与水的反应中,氧化剂是Na2O2,还原剂是水
C. Na2O不稳定,能继续被O2氧化生成Na2O2
D. 都能与酸反应生成含氧酸盐,都是碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为了研究电化学原理设计了如图所示的装置,下列说法中错误的是( ) 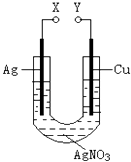
A.X和Y不连接时,铜棒上会有金属银析出
B.X和Y用导线连接时,银棒是正极,发生氧化反应
C.若X接直流电源的正极,Y接负极,Ag+向铜电极移动
D.无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列大小关系比较正确的是
A.离子半径:F-<Na+<Mg2+B.电负性:C<O<N
C.氢化物的沸点:NH3<PH3<AsH3D.碱性: NaOH)>Mg(OH)2> Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com