
【题目】SO2是一种酸性氧化物,溶于水生成亚硫酸。某同学对SO2的氧化性和亚硫酸的酸性进行了探究。回答下列问題:
(一)SO2的制备
该同学制备SO2的实验装置如下:

(1)装置A中发生反应的化学方程式为__________________________________________。
(2)装置C中盛有的是NaOH溶液,其作用是_________________________。
(二)验证SO2氧化性
待装置B中收集满SO2后,夹紧止水夹K1和K2取下装置 B,利用收集到的SO2验证其氧化性。
(3)设计一种验证SO2具有氧化性的方法:__________________________________________(要体现所使用检验试剂的名称和实验现象等要点)。
(4)将溶液R(足量)加人装置B的储气瓶中可将SO2排出进入检验试剂中,则溶液R是________。
(三)探究H2SO3的酸性强于HClO
由于次氯酸盐具有较强的氧化性,故不能直接将SO2通入次氯酸盐中检验H2SO3的酸性强于HClO,该同学用装置B中收集到的SO2,利用下面装置间接地完成了验证。

(5)装置的连接顺序为B→______________,F的作用是______________________________。
(6)可证明H2SO3的酸性强于HClO的实验现象是___________________________。
【答案】 Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 吸收SO2,防止其污染空气 将SO2通入氢硫酸溶液(或Na2S溶液、NaHS溶液)中,若出现黄色沉淀(或淡黄色沉淀或出现淡黄色浑浊或黄色浑浊),即可证明SO2具有氧化性 饱和NaHSO3溶液 D→F→E→G 除去未反应的SO2 E中的品红溶液不褪色,G中出现白色沉淀
【解析】(1)装置A中70%的浓硫酸与Na2SO3固体粉末作用生成SO2和Na2SO4,发生反应的化学方程式为Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)多余的SO2有毒,对环境有污染,利用装置C中盛有的是NaOH溶液,吸收SO2,防止其污染空气;
(3)欲体现SO2具有氧化性,需要使SO2遇还原性较强的气体或溶液作用,可通过将SO2通入氢硫酸溶液(或Na2S溶液、NaHS溶液)中,若出现黄色沉淀(或淡黄色沉淀或出现淡黄色浑浊或黄色浑浊),即可证明SO2具有氧化性。
(4)欲将储气瓶中可将SO2排出,选择的溶液应不能溶解SO2气体,可利用饱和NaHSO3溶液来实现;
(5)由于次氯酸盐具有较强的氧化性,故不能直接将SO2通入次氯酸盐中检验H2SO3的酸性强于HClO,可利用亚硫酸先制备CO2,利用CO2能使漂白粉溶液变浑浊来达到实验目的,同时要除去CO2中混有的SO2,排除SO2对实验的干扰,根据气体流向,装置的连接顺序为B→D→F→E→G,F的作用是利用盛放的酸性高锰酸钾溶液除去未反应的SO2;
(6)当E中的品红溶液不褪色,G中出现白色沉淀,说明碳酸的酸性比HClO强,而亚硫酸可制得CO2,由此可证明H2SO3的酸性强于HClO。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】现有下列有机物:
A.CH3CH2CHO和![]() B.
B.  和
和![]()
C.![]() 与
与![]() D.CH3CH=CH2和CH3CH2CH2Br
D.CH3CH=CH2和CH3CH2CH2Br
(1)上述各组化合物中,属于同系物的是________(填字母,下同),属于同分异构体的是________。
(2)C组中两种化合物的官能团的名称为________;区别B组中两种化合物的试剂为________。
(3)写出D组中CH3CH2CH2Br转化为CH3CH=CH2的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C6H12O2的有机物在酸性条件下可水解为酸和醇,且生成的醇没有相同官能团的同分异构体。若不考虑立体异构,该酯的同分异构体共 种
A. 6种B. 8种
C. 12种D. 16种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中最终可以得到Al(OH)3的是( )
A. Al2O3和水混合加热
B. 过量的稀HCl加入到NaAlO2溶液中
C. 过量的NaOH溶液加入到AlCl3溶液中
D. 过量的氨气通入到AlCl3溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3)常用于脱硫的催化剂。工业上利用软锰矿(主要成分是MnO2,还含有钙、铁、铝镁的氧化物及一些重金属的氧化物)制备无水碳酸锰的工艺流程如下:
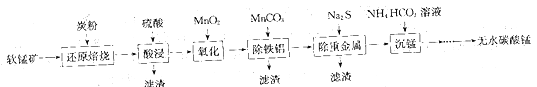
回答下列问题:
(1)为了提高“酸浸”步骤中原料的浸出率,可以采取的措施有___________(填字母)。
a.适当升温 b.连续搅拌 c.研磨矿石 d.加入足量的水
(2)“氧化”步骤中利用MnO2将溶液中Fe2+氧化为Fe3+,反应的离子方程式为_____________。
(3)“除铝铁”步骤中用MnCO3调节溶液pH的优点是___________________(写出一点),也可以用(填化学式)_____________代替MnCO3。
(4)“沉锰”步骤中反应温度需要控制在30~35℃以下,反应温度控制在35℃以下的原因是____,写出“沉锰”步骤中发生反应的化学方程式:________________________。
(5)25℃时,Ksp(MnCO3)=2.2×10-11,Ksp(MgCO3)=6.8×10-6。“沉锰”步骤中当Mn2+刚好沉淀完全[c(Mn2+)=1×10-5mol·L-1]时,若不析出MgCO3沉淀,则此时c(Mg2+)不能超过_____________mol·L-1(计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要除去碳酸氢钠溶液中混有的少量碳酸钠,最好采用
A.加入少量的澄清石灰水 B.加入适量的氢氧化钠溶液
C.将溶液加热蒸干并灼烧 D.通入足量的CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。

(1)在上图构想的物质和能量循环中太阳能最终转化为____________能。
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH,该反应的化学方程式为:2CO2(g)+4H2O(g)![]() 2CH3OH(g)+3O2(g)。
2CH3OH(g)+3O2(g)。
一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
①用CH3OH表示0~3 min内该反应的平均反应速率为______________________。
②能说明该反应已达到平衡状态的是_______________。
a.v正(H2O)=2v逆(CO2)
b.n(CH3OH) :n(O2)=2 :3
c.容器内密度保持不变
d.容器内压强保持不变
(3)用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的____极(填“正”或“负”),通入氧气的一极的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M可从酸牛奶中提取。已知纯净的M为无色黏稠液体, 易溶于水。为研究M的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取M4.5 g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空:(1)M的摩尔质量为: __ 。 |
(2)将此4.5 g M 在足量纯 O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6 g | (2)M的分子式为:____ 。 |
(3)通过M 的红外光谱图发现该分子中既有 羟基,还有羧基 | (3)写出M中含有的官能团羟基电子式:__ |
(4)M 的核磁共振氢谱如下图:
| (4)M 中含有___种氢原子。 |
(5)综上所述,M 的结构简式为_____ 。 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com