
已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10﹣10,Ksp(AgY)=1.0×10﹣12,Ksp(AgZ)=8.7×10﹣17.
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(已被溶解的溶质的物质的量/1L溶液)S(AgX)、S(AgY)、S(AgZ)的大小顺序为 .
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y﹣) (填“增大”“减小”或“不变”).
(3)在25℃时,若取0.188g的AgY(相对分子质量188)固体放入100mL水中(忽略溶液体积的变化),则溶液中Y﹣的物质的量浓度为 .
考点: 难溶电解质的溶解平衡及沉淀转化的本质.
专题: 电离平衡与溶液的pH专题.
分析: (1)结构相似的难溶性盐,溶度积越小,溶解度越小;
(2)AgY溶的溶度积比AgX小,从沉淀平衡移动的角度分析;
(3)0.188g的AgY(相对分子质量188)固体放入100mL水中,固体不能全部溶解.
解答: 解:(1)根据化学式相似的物质的溶度积常数越小,物质越难溶,溶解度越小,可知三者溶解度(mol/L)的大小顺序为S(AgX)>S(AgY)>S(AgZ),
故答案为:S(AgX)>S(AgY)>S(AgZ);
(2)AgX比AgY溶解度大,所以AgX饱和溶液中c(Ag+)较大,若向AgY的饱和溶液中加入少量AgX的固体,则c(Ag+)增大,AgY的沉淀溶解平衡逆移,所以c(Y﹣)将减小,故答案为:减小;
(3)0.188g的AgY(相对分子质量188)固体放入100mL水中,固体不能全部溶解,已知Ksp(AgY)=1.0×10﹣12,所以在25℃时饱和AgY溶液的浓度为c(AgY)=c(Ag+)=c(Y﹣)=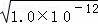 =1×10﹣6mol•L﹣1,故答案为:1×10﹣6 mol•L﹣1.
=1×10﹣6mol•L﹣1,故答案为:1×10﹣6 mol•L﹣1.
点评: 本题考查难溶电解质的溶解平衡及沉淀转化的本质,题目难度中等,本题注意溶度积常数的利用和理解.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
在溶液中加入足量Na2O2后仍能大量共存的离子组是()
A. NH4+、Ba2+、Cl﹣、NO3﹣ B. K+、AlO2﹣、Cl﹣、SO42﹣
C. Ca2+、Mg2+、NO3﹣、HCO3﹣ D. Na+、Cl﹣、CO32﹣、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W的原子序数依次增大,X是形成化合物最多的元素,且X常见化合价为+1和﹣1,Y原子最外层电子数是次外层的3倍;Z与X处于同一主族,W的原子序数是Y的2倍.下列叙述不正确的是()
A. 原子半径的大小顺序:r(Z)>r(W)>r(Y)>r(X)
B. 元素Y的简单气态氢化物的热稳定性比W的弱
C. 化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂
D. 由X、Y、Z、W四种元素组成的化合物其水溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
以下是对某溶液进行离子检验的方法和结论,其中正确的是()
A. 先加入BaCl2溶液,再加入HNO3溶液,产生了白色沉淀,则溶液中一定含有大量的SO42﹣
B. 加入足量的CaCl2溶液,产生了白色沉淀,则溶液中一定含有大量的CO32﹣
C. 加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO32﹣
D. 先加适量的硝酸将溶液酸化,再加入AgNO3溶液,产生了白色沉淀,则溶液中一定含有大量的Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂的废渣中混有少量的锌粉和氧化铜(其他成分不跟酸反应),跟大量废盐酸接触形成污水,产生公害.若向污水中撒入铁粉且反应后铁粉有剩余,此时污水中一定含有的金属离子是( )
|
| A. | Fe2+、Cu2+ | B. | Cu2+、H+ | C. | Zn2+、Fe2+ | D. | Zn2+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
|
| A. | 氢氧化钠与盐酸;氢氧化钠与碳酸 |
|
| B. | BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 |
|
| C. | Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液 |
|
| D. | 石灰石与硝酸反应;石灰石与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作正确的是()
A. 硫酸钠中含有少量碳酸钠,加入盐酸除去碳酸钠杂质
B. 萃取时,将酒精和碘化钾溶液放入分液漏斗中静置分层
C. 用分液漏斗分离互不相容的两种液体时,先放出下层液体,然后再放出上层液体
D. 配制一定物质的量浓度溶液定容时,用胶头滴管滴加蒸馏水至溶液凹液面最低点与刻度线相切
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列实验所选择的装置或仪器(夹持装置已略去)不正确的是()
A B C D
实验 证明浓硫酸有脱水性、强氧化性及SO2有还原性、漂白性 用于制取纯净的氢氧化亚铁 用于分离NH4Cl和I2的混合物 用于证明铁的吸氧腐蚀
装置或
仪器 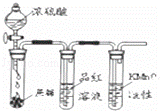
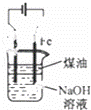

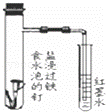
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com