
【题目】Ⅰ、某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图1为某实验小组设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
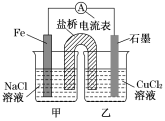
(2)如图,其他条件不变,若将乙烧杯中的CuCl2溶液换为NH4Cl溶液,则石墨电极的电极反应方程式为_____________________
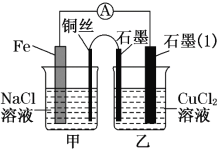
(3)如图,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如下图所示乙装置中与铜丝相连的石墨电极上发生的反应方程式为_____________________
Ⅱ、氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油等燃料相比,氢气作为燃料的两个明显的优点是________________(写两点)
(2)化工生产的副产品也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气。总反应方程式为:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如下图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如下图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
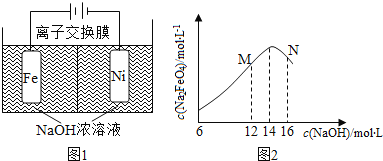
①电解一段时间后,c(OH)降低的区域在________________(填“阴极室”或“阳极室”)
②电解过程中,须将阴极产生的气体及时排出,其原因是______________________
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
【答案】Ⅰ、(1)0.2mol (2)2NH4++2e-=2NH3↑+H2↑ (3)2Cl--2e-=Cl2↑
Ⅱ、(1)燃烧热值高 燃烧无污染 是可再生能源 (写两点)(2)①阳极室
②防止生成的H2与高铁酸钠反应,使高铁酸钠的产率降低
③M点:氢氧根浓度偏小,高铁酸钠的稳定性差,且反应较慢;
N点:氢氧根浓度较大,铁电极上容易生成氢氧化铁,使高铁酸钠的产率降低
【解析】
试题分析:Ⅰ、(1)图1为原电池反应,Fe为负极,发生:Fe-2e-=Fe2+,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+=Fe2++Cu;一段时间后,两电极质量相差12g,则
Fe+Cu2+=Fe2++Cu 两极质量差△m 转移电子
56g 64g 56g+64g=120g 2mol
12g n
则:n=0.2mol。
(2)若将CuCl2溶液换为NH4Cl溶液,溶液呈酸性,铵根在正极放电,电极反应式为2NH4++2e-=2NH3↑+H2↑;
(3)若将盐桥换成弯铜导线与石墨相连成n型,甲装置为铁的吸氧腐蚀,铁为负极,铜为正极,正极发生 O2+2H2O+4e-=4OH-,呈碱性,滴加酚酞,溶液变红,则乙装置铜为阳极,石墨为阴极,乙为电解池装置,阳极发生2Cl--2e-=Cl2↑。
Ⅱ、(1)与汽油相比,氢气作为燃料的优点有污染小、可再生、来源广、资源丰富、燃烧热值高等;(2)①根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少,因此电解一段时间后,c(OH-)降低的区域在阳极室;
②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原。电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低;
③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)在与外界隔离的体系中,自发过程将导致体系的熵 ,(填“增大”、“减小”、“不变”);对于同一种物质, 时熵值最大。(填“固态”、“液态”、“气态”)
(2)某工厂实验室用CO和H2制备CH3OH,其原理为:CO(g)+2H2(g) ![]() CH3OH(g) △H < 0该温度下的化学平衡常数表达式_____________;若在298K、398K时化学平衡常数分别为K1、K2,则K1 K2(填“>”、“<”、“=”)
CH3OH(g) △H < 0该温度下的化学平衡常数表达式_____________;若在298K、398K时化学平衡常数分别为K1、K2,则K1 K2(填“>”、“<”、“=”)
(3)M与N是同素异形体,由M=N;△H=+119KJ/mol可知,M比N________(填稳定、不稳定)
(4)一定温度下,反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后, 保持压强不变,充入Ar,其正反应速率__________(A.变快 B.不变 C变慢,填字母代号);该反应向__________(填正移、逆移或不移)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2A(g) + B(g) ![]() 2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定:
2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定:
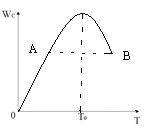
(1)T0对应的V正与V逆关系是V正___________V逆(填“>”、“<”、“=”)。
(2)A、B两点正反应速率的大小关系VA___________VB(填“>”、“<”、“=”)。
(3)温度T<T0时,Wc逐渐增大的原因是____________________;
(4)500℃条件下,该反应 K =2.33 ,测得某时刻,A(g)、B(g)、C(g)的浓度均为0.5mol/L,则此时v(正)____________v(逆)(填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适当的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如图所示的原电池。下列判断正确的是 ( )
2Fe2++I2设计成如图所示的原电池。下列判断正确的是 ( )

A.反应开始时,乙中电极反应为2I-+2e-= I2
B.反应开始时,甲中石墨电极上发生氧化反应
C.电流表指针为零时,两池溶液颜色不相同
D.平衡时甲中溶入FeCl2固体后,乙池的石墨电极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,不是可逆反应2A(g)+3B(s)![]() 2C(g)达到平衡标志的是( )
2C(g)达到平衡标志的是( )
①C的生成速率与C的分解速率相等;②单位时间生成amol A,同时消耗1.5amol B;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2:3:2。
A.②⑤⑧ B.⑤⑥⑧ C.①③④ D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)我国《可再生能源法》倡导资源的高效转化及循环利用。下列做法错误的是
A.回收废旧电池,其主要目的是回收其中的金属
B.大力发展煤的气化及液化技术
C.用聚乙烯塑料代替聚乳酸塑料可减少白色污染
D.加快石油等化石燃料的开采和使用
E.以CO2为原料生产可降解塑料
F.将秸秆进行加工转化为乙醇燃料
(2)用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是
A.NaCl B.H2SO4 C.CuCl2 D.AgNO3
(3)Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,石墨电极附近溶液的pH (填增大、减小、不变)

(4)一定条件下,充分燃烧一定量的丁烷放出热量为Q kJ,经测定完全吸收燃烧后生成的二氧化碳气体需消耗5 mol·L-1的KOH溶液100 mL,且恰好生成正盐。则此条件下反应:C4H10(g)+![]() O2(g)=4CO2(g)+5H2O(l)的ΔH ﹦
O2(g)=4CO2(g)+5H2O(l)的ΔH ﹦
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相结合的新工艺可以节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中甲、乙、丙、丁均为石墨电极。

①若装置中通过0.5 mol e-,则理论上甲电极生成X气体的体积为__________L(标准状况下)
②图中NaOH溶液的质量分数a﹪、b﹪、c﹪由大到小的顺序为________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青苹果汁遇碘溶液显蓝色,熟苹果汁能还原银氨溶液,这说明 ( )
A. 青苹果中只含淀粉不含糖类 B. 熟苹果中只含糖类不含淀粉
C. 苹果转熟时淀粉水解为单糖 D. 苹果转熟时单糖聚合成淀粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有九种物质:①金属铜 ②固态NaCl ③O2 ④H2SO4 ⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液 ⑧熔融的KNO3⑨葡萄糖.
其中属于电解质的是 ,
属于非电解质的是 ,
能够导电的是(用序号填写).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com