
【题目】向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s) ![]() bZ(g) △H<0。图是容器中X、Z的物质的量浓度随时间变化的曲线。根据以上信息,下列说法正确的是
bZ(g) △H<0。图是容器中X、Z的物质的量浓度随时间变化的曲线。根据以上信息,下列说法正确的是

A.根据上图可求得方程式中a∶b=1:3
B.推测在第7min时曲线变化的原因可能是加压
C.推测在第13min时曲线变化的原因可能是升温
D.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)石油和煤是重要的能源物质,下列说法错误的是___。
a.石油和煤是不可再生能源
b.煤为混合物,含有苯、甲苯、二甲苯等有机物
c.煤的干馏和石油的分馏都是物理变化
d.煤燃烧及汽车尾气是造成空气污染的重要原因
e.以煤、石油为原料可生产塑料、合成橡胶、合成纤维等合成材料
(2)以煤为原料经过一系列反应可生产乙酸乙酯,其合成路线如下:
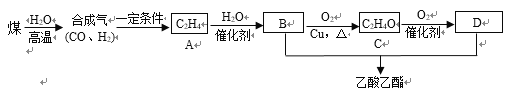
①C的名称是______;A→B的反应类型是_______。
②决定化合物B性质的基团名称是_________。
③B→C的化学方程式为_______________________________。
B+D→乙酸乙酯的化学方程式为________________________________。
(3)某化学实验小组的同学,采用如图装置制取乙酸乙酯。

①仪器B的名称是_______;仪器A中冷却水的进口是_____(填“a”或“b”)。
②观察仪器A的内层结构,与长直导管相比较,该反应装置的优点是_______。
③将乙醇和乙酸按照物质的量3∶2混合得到258g混合液,在浓硫酸作用下发生反应,乙酸乙酯的产率为50%,则生成的乙酸乙酯的质量是_______g。(相对分子质量:乙醇—46,乙酸—60,乙酸乙酯—88)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以煤为主要原料可以制备乙二醇,相关工艺流程如下:
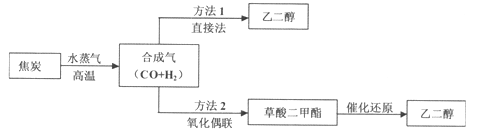
(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式_______
(2)合成气在不同催化剂作用下,可以合成不同的物质。下列物质仅用合成气为原料就能得到且原子利用率为100%的是_____填字母)。
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成份为CH4)与C02反应制备合成气。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
2H2(g)+ O2(g)= 2H2O(l) △H=-571.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
则CH4与CO2生成合成气的热化学方程式为____________________。
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:
CH3OOC—COOCH3(g)+ 4H2(g)![]() HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为提高乙二醇的产量和速率,宜采用的措施是___________(填字母)。
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:CH3OOC—COOCH3+ 2H2O![]() HOOC—COOH+2CH3OH
HOOC—COOH+2CH3OH
①草酸是二元弱酸,可以制备![]() (草酸氢钾),
(草酸氢钾),![]() 溶液呈酸性,用化学平衡原理解释:__________________。
溶液呈酸性,用化学平衡原理解释:__________________。
②在一定的![]() 溶液中滴加NaOH溶液至中性。下列关系一定不正确的是_______(填字母)。
溶液中滴加NaOH溶液至中性。下列关系一定不正确的是_______(填字母)。
A.![]()
B.![]()
C.![]()
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的_____填“正”或“负”)极,负极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为原料制备某些物质的转化关系如下图所示(图中部分反应条件及生成物未给出)。

(1)检验有机物C中官能团的常用试剂是________________________(写出一种即可)。
(2)写出反应③的化学方程式____________________________。
(3)有机物E有多种同分异构体,写出与E属于同类物质的同分异构体的结构简式(不包括E)____________、____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素及其化合物叙述中不正确的是( )
A.氧化镁和氧化铝熔点均很高,常用作耐高温材料
B.在酒精灯加热条件下,![]() 和
和![]() 固体都能分解
固体都能分解
C.二氧化氯具有氧化性,可用于自来水杀菌消毒
D.电闪雷鸣的雨天,![]() 与
与![]() 会发生反应并最终转化为硝酸盐被植物吸收
会发生反应并最终转化为硝酸盐被植物吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.0500 mol·L-1H2C2O4溶液滴定 25.00 mL0.l000mol·L-1NaOH溶液所得滴定曲线如图。下列说法正确的是()

A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
B.点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C.点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
⑴ 该结晶水合物中含有的两种阳离子是________和________,阴离子是_________。
⑵ 试通过计算确定该结晶水合物的化学式。________
⑶ 假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系________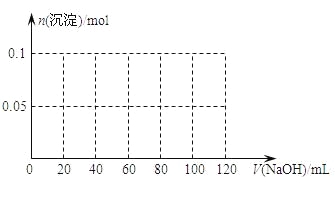
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸生产中,500℃时,NH3和O2可能发生如下反应:
① 4NH3 (g) + 5O2 (g) ![]() 4NO (g) + 6H2O (g);△H = -907.2kJ·mol-1 K=1.1×1026
4NO (g) + 6H2O (g);△H = -907.2kJ·mol-1 K=1.1×1026
② 4NH3 (g) + 4O2 (g) ![]() 2N2O (g) + 6H2O (g);△H= -1104.9kJ·mol-1 K=4.4×1028
2N2O (g) + 6H2O (g);△H= -1104.9kJ·mol-1 K=4.4×1028
③ 4NH3 (g) + 3O2 (g) ![]() 2N2 (g) + 6H2O (g);△H= -1269.2kJ·mol-1 K=7.1×1034
2N2 (g) + 6H2O (g);△H= -1269.2kJ·mol-1 K=7.1×1034
下列说法正确的是
A.增大压强,则反应的②K不变,反应①和③的K减小
B.500℃时,2NH3 (g) + 2O2 (g) ![]() N2O (g) + 3H2O (g) K=2.2×1028
N2O (g) + 3H2O (g) K=2.2×1028
C.500℃时,N2 (g) + O2 (g)= 2NO (g) △H = +181 kJ·mol-1
D.500℃时,2 mol NH3 与2.5 mol O2混合发生反应①,可放出热量453.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出如下光分解法制备氢气:
①2Ce4+(aq)+H2O(l)===2Ce3+(aq)+![]() O2(g)+2H+(aq) ΔH1
O2(g)+2H+(aq) ΔH1
②Ce3+(aq)+H2O(l)===Ce4+(aq)+![]() H2(g)+OH-(aq) ΔH2
H2(g)+OH-(aq) ΔH2
③H2O(l)===H+(aq)+OH-(aq) ΔH3
④2H2O(l)===2H2(g)+O2(g) ΔH4
下列说法正确的是( )
A. Ce4+能够增大水分解反应的活化能,提高反应速率
B. Ce3+是反应②和反应③的催化剂
C. 上述反应中,ΔH4=2ΔH1+4ΔH2-4ΔH3
D. 通常条件下,反应④中生成H2、O2的速率之比为1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com