
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)===I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)下列说法不正确的是
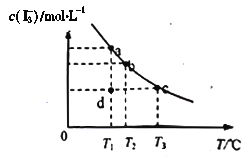
A. 温度为T1时,向该平衡体系中加入KI固体,平衡正向移动
B. 反应I2(aq)+I-(aq)===I3-(aq) △H<0
C. 若T1时,反应进行到状态d时,一定有v正>v逆
D. 状态a与状态b相比,状态b时I2的转化率更高
科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)天然气和可燃冰(mCH4·nH2O)既是高效洁净的能源,也是重要的化工原料,
①甲烷分子的空间构型为__________,可燃冰(mCH4·nH2O)属于________晶体。
②已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.65kJ热量,则该条件下反应
CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H=______kJ·mol-1
(2)用甲烷-氧气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。反应装置如下图所示:
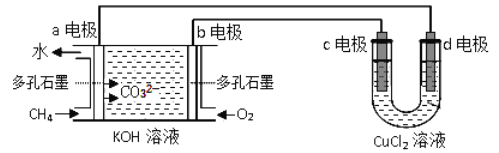
①b电极名称为___________,d电极的电极反应式为_________。
②假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,理论上燃料电池消耗氧气在标准状况下的体积是______ mL。
(3)在相同条件下,下面各组热化学方程式中,△H1<△H2的是________。(填字母)
A组:2H2(g)+O2(g)=2H2O(g) △H1 2H2(g)+O2(g)═2H2O(l) △H2
B组:S(g)+O2(g)=SO2(g) △H1 S(s)+O2(g)=SO2(g) △H2
C组:C(s)+1/2O2(g)=CO(g) △H1 C(s)+O2(g)=CO2(g) △H2
D组:CO(g)+1/2O2(g)=CO2(g) △H1 2CO(g)+O2(g)=2CO2(g) △H2
(4)25℃,10lkPa条件下,14gN2和3gH2应生成NH3的能量变化如下图所示:

己知:①x=1127;
②25℃101kPa下,N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJ·mol-1。则y=___________。
2NH3(g) △H=-92kJ·mol-1。则y=___________。
(5)金属材料的腐蚀是人类面临的严重问题,金属的防腐对节约能源、保护环境起着十分重要的作用。下列三个装置中,铁被腐蚀速率由快到慢的顺序为_________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH ![]() H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH—)+c(CH3COO—)
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH—)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 1L1mol/LCH3COOH溶液中的分子数小于NA
B. 热纯碱溶液用于清洗餐具表面的油污
C. 有单质参加的化学反应一定是氧化还原反应
D. 动植物油脂是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H+++OH+;ΔH>0,下列叙述正确的是( )
H+++OH+;ΔH>0,下列叙述正确的是( )
A.向水中加人稀氨水,平衡逆向移动,c(OH—)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加人少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4,在调节溶液pH值时应选用的试剂是
A. NaOH B. NH3·H2O C. ZnO D. Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.将等物质的量的X、Y的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下发生可逆反应。下列说法正确的是
A. 达到化学平衡时,正反应速率与逆反应速率不相等
B. 反应过程中,Y的单质的体积分数始终为50%
C. 达到化学平衡时,X、Y的两种单质在混合气体中的物质的量之比为1:1
D. 达到化学平衡的过程中,混合气体平均相对分子质量逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色酸性溶液中能大量共存的一组离子是
A.Na+、K+、CO32-、NO3- B.K+、MnO4-、NH4+、NO3-
C.NH4+、SO42-、Al3+、NO3- D.Na+、Ca2+、NO3-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,在潮湿空气中易水解氧筑化,且在氯离子浓度较大的体系中存在CuCl+Cl-=[CuCl2]-。工业上用低品铜矿(主要含CuS、Cu2S、FeO等)制备CuCl的一种工艺流程如下:
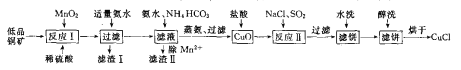
回答下面问题:
(1)反应I中被氧化的元素有_________。(填元素符号)
(2)滤渣II的成分主要为MnCO3,写出除Mn2+的离于方程式_________。
(3)写出反应II中发生反应的离子方程式_________。
(4)在进行反应II时,通入的SO2一般都要适当过量,目的是_________。
(5)滤饼进行醇洗的目的是_________。
(6)在进行反应II时,当氯化钠用量增加到一定程度后氯化亚铜的沉淀率减小,原因是_________。
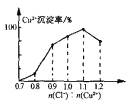
(7)Cu2+的沉淀率是指转化为CuCl的n(Cu2+)占总的n(Cu2+)的百分比。在一定条件下Cu2+沉淀率与沉淀前的Cl-、Cu2+的物质的量之比[n(Cl-): n(Cu2+)]的关系如下图所示。CuCl+Cl-![]() [CuCl2]-的平衡常数K=6.5×10-2,则该条件下Cu2+的最大沉淀率为_________。(保留两位小数)。
[CuCl2]-的平衡常数K=6.5×10-2,则该条件下Cu2+的最大沉淀率为_________。(保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com