
(10分)铝和氢氧化钠都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 ________________ 。
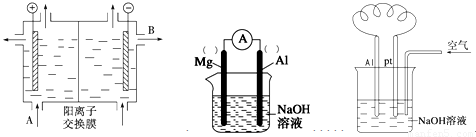
(2)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如左下图所示。
①请写出A、B两处物质的名称:A___________________、B____________________
②请写出电解食盐水的离子方程式__________________________________________
(3)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池如上中图。?
①负极材料为________(填Mg或Al)。
②该原电池的总反应式为____________________________________________
(要求用单线桥标出电子转移的方向和数目)
(4)铝—空气燃料电池可用于电动汽车,通常以NaOH溶液为电解液,铝合金为负极,通入空气的极为正极(如右上图),则
负极的电极反应式为 ______________________ ;
正极的电极反应式为___________________________________。
科目:高中化学 来源: 题型:
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
(2)铝和氢氧化钾都是重要的工业产品。请回答:
①工业冶炼铝的化学方程式是______________________________________________。
②铝与氢氧化钾溶液反应的离子方程式是___________________________________________。
③工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如下图所示。

a.该电解槽的阳极反应式是_________________________________________________。
b.通电开始后,阴极附近溶液pH会增大,请简述原因________________________________。
c.除去杂质后的氢氧化钾溶液从液体出口____________(填写“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源:2013届江西省高二第二次月考化学试卷 题型:填空题
(10分)铝和氢氧化钠都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 ________________ 。
(2)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如左下图所示。
①请写出A、B两处物质的名称:A___________________、B____________________
②请写出电解食盐水的离子方程式__________________________________________
(3)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池如上中图。?
①负极材料为________(填Mg或Al)。
②该原电池的总反应式为____________________________________________
(要求用单线桥标出电子转移的方向和数目)
(4)铝—空气燃料电池可用于电动汽车,通常以NaOH溶液为电解液,铝合金为负极,通入空气的极为正极(如右上图),则
负极的电极反应式为 ______________________ ;
正极的电极反应式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)用坩埚钳夹住一块擦去氧化膜的铝片,放在酒清灯火焰上灼烧,铝片表面接触火焰的部分变暗,片刻后变软;轻轻摇动,会左右摇晃,却不像蜡烛那样滴落。这是因为铝表面氧化膜的__________内层的铝并将其裹住,所以不易发生熔滴现象。试写出灼烧铝的化学方程式:________________________________________。
(2)取2条未用砂纸打磨过的铝片,一片浸入CuCl2稀溶液中其表面产生许多无色气泡,很快析出较多红色粉末状固体;而另一片浸入CuSO4稀溶液中现象一直不明显。试猜测产生这种现象差异的原因是___________________________________________________________。
(3)用砂纸打磨一铝片使其表面较粗糙,再将其放入CuSO4稀溶液中,2—3 min后,铝片表面有气泡,并有少量红色固体附着。试写出铝片表面附着红色固体的离子方程式为_____
_____________________________________________________________________。
(4)再取2条铝片,用砂纸擦去氧化膜,都浸入浓硝酸中,无显著变化,5 min后取出,用水洗净。其后将两铝片分别浸入CuCl2、CuSO4两种稀溶液中,现象同(2)。铝片浸入浓硝酸中无显著变化的原因是________________________________________________________。
(5)另取2条未用砂纸打磨过的铝片,都浸入氢氧化钠溶液中,片刻后其表面产生无色气泡,5 min后取出,用水洗净。其后将两铝片分别浸入CuCl2、CuSO4两种稀溶液中,现象与(2)相似。试写出铝的氧化膜与碱液反应的离子方程式:________________________________。
(6)向步骤(2)、(4)和(5)中的CuSO4稀溶液中滴入3—5滴NaCl稀溶液,铝片表面逐渐产生气泡,且有红色固体析出。
因此据步骤(2)、(4)、(5)和(6)的现象可以得出的结论是________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省南昌二中高二第二次月考化学试卷 题型:填空题
(10分)铝和氢氧化钠都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 ________________ 。
(2)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如左下图所示。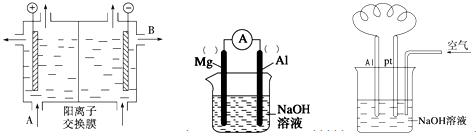
①请写出A、B两处物质的名称:A___________________、 B____________________
B____________________
②请写出电解食盐水的离子方程式__________________________________________
(3)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池如上中图。?
①负极材料为________(填Mg或Al)。
②该原电池的总反应式为____________________________________________
(要求用单线桥标出电子转移的方向和数目)
(4)铝—空气燃料电池可用于电动汽车,通常以NaOH溶液为电解液,铝合金为负极,通入空气的极为正极(如右上图),则
负极的电极反应式为 ______________________ ;
正极的电极反应式为_______________ ____________________。
____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com