
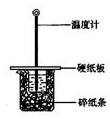
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.5℃ | |
分析 (1)根据量热计的构造来判断该装置的缺少仪器;
(2)不盖硬纸板,会有一部分热量散失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)弱电解质电离吸热;根据中和热的概念分析;
(5)先判断温度差的有效性,然后求出温度差平均值,再根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热,根据中和热的概念以及热化学方程式的书写方法写出热化学方程式;
解答 解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,
故答案为:偏小;
(3)反应放出的热量和所用酸以及碱的量的多少有关,如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高;但中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,中和热数值相等;
故答案为:不相等;相等;中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关;
(4)一水合氨为弱碱,电离过程为吸热过程,用相同浓度和体积的氨水代替NaOH溶液进行上述实验,反应放出的热量偏小;在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热,若用KOH代替NaOH,测定结果无影响;
故答案为:偏小;无影响;
(5)2次温度差分别为:3.3℃,3.5℃,2组数据都有效,温度差平均值为3.4℃,50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液质量和为m=100mL×1g/mL=100g,c=4.18J/(g•℃),△T=3.4℃,代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.4℃=1421.2J=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量为$\frac{1.4212kJ×1mol}{0.025mol}$=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol,NaOH溶液与HCl溶液反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.8kJ/mol,
故答案为:①-56.8kJ/mol;
②HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.8kJ/mol;
点评 本题考查中和热的测定与误差分析,题目难度不大,理解中和热测定原理是解答关键,试题有利于培养学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
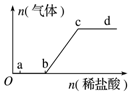 向Na2CO3、NaHCO3混合溶液中逐滴滴入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴滴入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Al3+、H+、SO42-、NO3- | |
| B. | b点对应的溶液中:Ca2+、Na+、OH-、Cl- | |
| C. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:F-、NO3-、Fe3+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol的CH4质量为16g/mol | |
| B. | 3.01×1023个CO2分子的质量约为22g | |
| C. | H2O的摩尔质量为18g | |
| D. | 标准状况下,1 mol任何物质体积均为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度和压强下,各种气体物质体积的大小由构成气体的分子大小决定 | |
| B. | 一定温度和压强下,各种气态物质体积的大小,由构成气体的原子数决定 | |
| C. | 无论外界条件是否相同,不同的气体,若物质的量不同,则它们所含的分子数也不同 | |
| D. | 相同状况下,相同微粒数的Fe、H2O、H2的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com