
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2000 |
| K | 3.84×10-31 | 0.1 |
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系的 能量变化 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 放热23.1kJ |
| b | 0.6 | 1.8 | 0.8 | 吸热Q kJ |
分析 (1)①温度越高,K越大,说明升高温度,平衡正移;
②K值很小,转化率很小;
(2)从等效平衡的角度分析,0.6molN2、1.8molH2和0.8molNH3相当1molN2、3molH2,在相同条件下处于相同平衡状态,所以平衡时两个容器内N2的平衡浓度c(N2)和NH3的平衡浓度c(NH3)相等,据此分析计算;
(3)已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律:①×2-②×3得2N2(g)+6H2O(l)?4NH3(g)+3O2(g),据此分析.
解答 解:(1)①由表格数据可知,温度越高,K越大,说明升高温度,平衡正移,则正反应方向为吸热反应,故答案为:吸热;
②由表格数据可知,2000℃时,K=0.1,K值很小,则转化率很小,不适合大规模生产,所以人类不适合大规模模拟大气固氮,
故答案为:K值小,正向进行的程度小(或转化率低),不适合大规模生产;
(2)从等效平衡的角度分析,0.6molN2、1.8molH2和0.8molNH3相当1molN2、3molH2,在相同条件下处于相同平衡状态,所以平衡时两个容器内N2的平衡浓度c(N2)和NH3的平衡浓度c(NH3)相等;
则 N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
初始:1 3 0 92.4kJ
变化:0.25 0.75 0.5 23.1kJ
平衡:0.75 2.25 0.5
①所以容器a达平衡时N2的平衡浓度c(N2)=$\frac{0.75mol}{0.25L}$=3mol/L,故答案为:3mol/L;
②所以容器b达平衡时NH3的平衡浓度c(NH3)=$\frac{0.5mol}{0.25L}$=2mol/L,故答案为:2mol/L;
③A.根据以上分析,容器a达平衡时NH3的物质的量是0.5mol,故正确;
B.根据以上分析,平衡时NH3的物质的量是0.5mol,所以容器b开始是向合成氨的逆反应方向进行,故正确;
C.若容器a体积变为0.2L,即减小体积,平衡向正反应方向移动,则达平衡时放出的热量大于23.1kJ,故错误;
D.因为a、b在相同条件下处于相同平衡状态,所以能利用已知数据计算容器b的平衡常数,故错误;
故选:AB;
(3)已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律:①×2-②×3得2N2(g)+6H2O(l)?4NH3(g)+3O2(g),△H=(-92.4kJ•mol-1)×2-(-571.6kJ•mol-1)×3=+1530 kJ•mol-1;
故答案为:+1530 kJ•mol-1.
点评 本题考查了平衡常数的应用、合成氨反应的条件选择、影响化学平衡的因素、盖斯定律的应用等,题目难度中等,侧重于基础知识的综合应用考查,注意把握K与温度的关系以及影响化学平衡的因素.


 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 无机物 | B. | 有机物 | C. | 盐类 | D. | 单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极的反应式是:PbO2+SO42-+4H++2e-═PbSO4+2H2O | |
| B. | 放电时,电解质溶液中的H+向负极移动 | |
| C. | 充电时,阳极的电极反应为:PbSO4+2e-═Pb(s)+SO42- | |
| D. | 充电时,当有20.7gPb生成时,转移的电子为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水能区分乙酸、乙烯、苯、四氯化碳 | |
| B. | 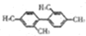 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| C. | 甘氨酸(H3N-CH2COOH)、丙氨酸[CH3CH(NH2)COOH]、谷氨酸[HOOC-CH2CH2CH(NH2)COOH]一定条件下形成链状三肽的结构最多有3种 | |
| D. | 1mol有机物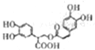 一定条件下能和6molNaOH反应 一定条件下能和6molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiC中硅元素的化合价为-4价,SiC属于共价化合物 | |
| B. | 标准状况下,22.4LCCl4中所含共价键数目为4NA | |
| C. | 该反应中CCl4是还原剂 | |
| D. | 每转移8mol电子,会生成1molSiC |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 8:7 | B. | 2:7 | C. | 1:1 | D. | 1:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com