
【题目】以海水为原料可以提取金属镁,下图是某工厂从海水中提取镁的主要步骤。讨论以下相关问题

(1)在海水提镁的过程中如何实现对镁离子的富集,有三个学生提出自己的观点。
学生甲的观点:直接往海水中加入沉淀剂。
学生乙的观点:高温加热蒸发海水后,再加入沉淀剂。
学生丙的观点:利用晒盐后的苦卤水,再加入沉淀剂。
通过分析比较你认为学生_____的观点正确(填学生序号)。
(2)为了使镁离子沉淀下来,充分利用当地的贝壳(主要成分为碳酸钙)资源获得沉淀剂,加入的试剂①是_________(填化学式)。写出由贝壳制取试剂①的相关化学方程式:___________;
(3)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_________(填标号字母)
A.蒸馏 B.分液 C.过滤 D.萃取
(4)加入的试剂②是________(填化学式)。工业过程中常常将蒸发结晶后的氯化镁水合物晶体再置于HCl气流中加热获得无水MgCl2,其目的是______________________________。
(5)写出由无水MgCl2制取金属镁的化学方程式_____________________________。
【答案】丙 Ca(OH)2 CaCO3 ![]() CaO +CO2 ↑;CaO+H2O=Ca(OH)2 C HCl 抑制水解,得到纯净的无水氯化镁 MgCl2(熔融)
CaO +CO2 ↑;CaO+H2O=Ca(OH)2 C HCl 抑制水解,得到纯净的无水氯化镁 MgCl2(熔融) ![]() Mg+Cl2 ↑
Mg+Cl2 ↑
【解析】
首先向混合物中加入碱,反应生成氢氧化镁沉淀,分离沉淀和滤液,再将氢氧化镁与盐酸反应生成氯化镁,蒸发结晶后,电解熔融的氯化镁,进而得到金属镁,根据物质的制备和提纯的流程分析解答。
(1)学生甲与其他观点相比,海水中镁离子浓度小,使用的沉淀剂的量较大,且不利于收集氢氧化镁,因此学生甲的观点不正确,原因是:海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀;学生乙与其他观点相比,高温蒸发海水,消耗的能源多,成本太高,因此学生乙的观点不正确,原因是:能源消耗大,海水的综合利用低,成本高;学生丙与学生乙相比,利用晒盐后的苦卤,节约能源,成本低;与学生甲相比镁离子浓度高,有利于镁元素的富集;因此学生丙的观点正确,因为:镁离子富集浓度高,成本低;
故答案为:丙;
(2) 因碳酸钙高温分解得到氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙能与氯化镁反应生成氢氧化镁,方程式为:CaCO3 ![]() CaO +CO2 ↑, CaO+H2O=Ca(OH)2;
CaO +CO2 ↑, CaO+H2O=Ca(OH)2;
故答案为:Ca(OH)2,CaCO3 ![]() CaO +CO2 ↑;CaO+H2O= Ca(OH)2;
CaO +CO2 ↑;CaO+H2O= Ca(OH)2;
(3)分离难溶固体与液体的混合物,应使用过滤操作;
故答案为:C;
(4) 要使氢氧化镁转化为氯化镁,则需要加入盐酸反应,即试剂②是盐酸,由于Mg2+会发生水解,生成氢氧化镁,故工业过程中常常将蒸发结晶后的氯化镁水合物晶体再置于HCl气流中加热获得无水MgCl2,从而抑制Mg2+的水解;
故答案为:HCl,抑制水解,得到纯净的无水氯化镁;
(5)利用电解熔融状态的氯化镁获得金属镁;MgCl2(熔融) ![]() Mg+Cl2 ↑
Mg+Cl2 ↑
故答案为:MgCl2(熔融) ![]() Mg+Cl2 ↑。
Mg+Cl2 ↑。


科目:高中化学 来源: 题型:
【题目】电导率用于衡量电解质溶液导电能力的大小,与离子浓度和离子迁移速率有关。图1 为相同电导率盐酸和醋酸溶液升温过程中电导率变化曲线,图2 为相同电导率氯化钠和醋酸钠溶液升温过程中电导率变化曲线,温度均由22℃上升到70℃。下列判断不正确的是

A. 由曲线1可以推测:温度升高可以提高离子的迁移速率
B. 由曲线4可以推测:温度升高,醋酸钠电导率变化与醋酸根的水解平衡移动有关
C. 由图1和图2可以判定:相同条件下,盐酸的电导率大于醋酸的电导率,可能的原因是Cl-的迁移速率大于CH3COO-的迁移速率
D. 由图1和图2可以判定:两图中电导率的差值不同,与溶液中H+、OH-的浓度和迁移速率无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对含硼(元素符号为“B”)物质结构的研究,极大地推动了结构化学的发展。回答下列问题:
(1)基态B原子价层电子的电子排布式为_____,核外电子占据最高能层的符号是____,占据该能层未成对电子的电子云轮廓图形状为____。
(2)1923年化学家Lewis提出了酸碱电子理论。酸碱电子理论认为:凡是可以接受电子对的物质称为酸,凡是可以给出电子对的物质称为碱。已知BF3与F-反应可生成BF4-,则该反应中BF3属于____(填“酸”或“碱”),原因是____。
(3)NaBH4是有机合成中常用的还原剂,NaBH4中的阴离子空间构型是_____,中心原子的杂化形式为____,NaBH4中存在____(填标号)
a.离子键 b.金属键 c.σ键 d.π键 e.氢键
(4)请比较第一电离能:IB____IBe(填“>”或“<”),原因是_______。
(5)六方氮化硼的结构与石墨类似,B—N共价单键的键长理论值为158pm,而六方氮化硼层内B、N原子间距的实测值为145 pm,造成这一差值的原因是____。高温高压下,六方氮化硼可转化为立方氮化硼,立方氮化硼的结构与金刚石类似,已知晶胞参数中边长为a=362 pm,则立方氮化硼的密度是____g/cm3。
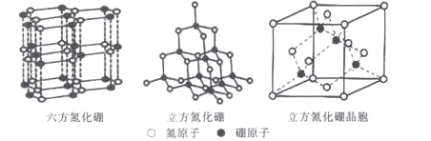
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是

A. P4S3中磷元素为+3价
B. P4S3属于共价化合物
C. P4S3充分燃烧的化学方程式为P4S3+8O2=P4O10+3SO2
D. 1mol P4S3分子中含有9mol共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统接触法制取硫酸能耗大,污染严将燃料电池引人硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。
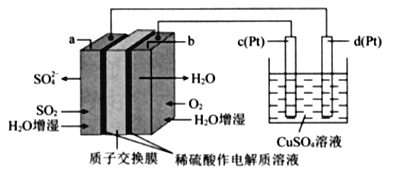
下列说法不正确的是( )
A. b极为正极,电极反应式为O2+4H++4e-=2H20
B. H+由a极通过质子交换膜向b极移动
C. 该燃料电池的总反应式为2SO2+O2+2H2O=2H2SO4
D. 若a极消耗2.24 L(标准状况)SO2,理论上c极,有6.4g铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的元素定量分析最早是由德国人李比希提出的,某实验室模拟李比希法测定某种氨基酸(CxHyOzNp)的分子组成。取一定量的该氨基酸放在纯氧气中燃烧,燃烧后生成的水用装置D(无水氯化钙)吸收,二氧化碳用装置C(KOH浓溶液)吸收,N2的体积用E装置进行测量,所需装置如下图(夹持仪器的装置及部分加热装置已略去):

(1)该实验装置的合理连接顺序为:A、__、E。(部分装置可以重复选用)
(2)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧,这样做的目的是_____。
(3)A中放入CuO的作用是_______,装置B的作用是_____。
(4)为了确定此氨基酸的分子式,除了准确测量N2的体积、生成二氧化碳和水的质量外,还需得到的数据有___。
(5)在读取E装置中所排水的体积时,液面左低右高,则所测气体的体积____(填“偏大”、“偏小”或“无影响”)。
(6)已知分子式为C2H4O2的有机物也含有氨基酸中的某个官能团,请设计实验证明该官能团(试剂任选):____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色金属,化学性质稳定,在化合物中常见+2、+3 和+6 价等价态。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知 Na2Cr2O7 是一种强氧化剂),其主要工艺流程如下:

查阅资料得知:常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式_______________。
(2)酸化滤液D时,不选用盐酸的原因是_____________。
(3)固体E的主要成分是Na2SO4,根据如图分析操作a为________________、____________、洗涤、干燥。
(4)已知含+6 价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-。
![]()
①Cr(OH)3的化学性质与 Al(OH)3相似。在上述生产过程中加入NaOH 溶液时要控制溶液的pH不能过高,是因为__________________________(用离子方程式表示);
②下列溶液中可以代替上述流程中Na2S2O3溶液最佳的是___________(填选项序号);
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③上述流程中,每消耗0.1 mol Na2S2O3 转移0.8 mole-,则加入Na2S2O3溶液时发生反应的离子方程式为__________________________________。
(5)某厂废水中含1.00×103 mol/L的Cr2O72-,某研究性学习小组为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4(Cr 的化合价为+3,Fe的化合价依次为+3、+2)。欲使1L该废水中的 Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入________gFeSO47H2O。
(已知FeSO47H2O摩尔质量为278g/mol)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关沉淀溶解平衡的说法中,正确的是( )
A.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大
B.在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动
C.可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小
D.25 ℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应Fe2O3 +3CO![]() 2Fe+3CO2,回答下列问题:
2Fe+3CO2,回答下列问题:
(1)Fe2O3是________剂,化合价_____(填“升高”或“降低”), _____电子(填“得”或“失”),发生______反应;
(2)还原性:CO_________Fe(填“大于”、“等于”或“小于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com