
【题目】[2019·武汉市武昌区高三五月调研考试]室温下,用0.100 mol·L1的NaOH溶液分别滴定均为20.00mL0.100 mol·L1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是
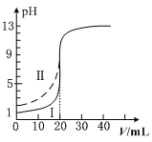
A. Ⅰ表示的是滴定醋酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)>20.00mL
C. V(NaOH)=20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
D. V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
【答案】C
【解析】
A. 未滴加NaOH溶液时,0.1mol/L盐酸pH=1,0.1mol/L醋酸pH>1,所以滴定盐酸的曲线是图Ⅰ,故A错误;
B. V(NaOH)=20.00mL时恰好生成醋酸钠,溶液呈碱性,若pH=7,则加入的氢氧化钠溶液体积应该稍小,即V(NaOH)<20.00mL,故B错误;
C. V(NaOH)=20.00mL时,二者反应生成氯化钠和醋酸钠,醋酸根发生水解,浓度小于氯离子,即c(Cl-)>c(CH3COO-),故C正确;
D. V(NaOH)=10.00mL时,与醋酸反应后得到等浓度的醋酸和醋酸钠的混合溶液,由于醋酸的电离程度大于醋酸根离子的水解程度,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可知:c(CH3COO-)>c(Na+),溶液中正确的离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D错误;
故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下可能大量共存的是
A. 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C. 在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3-
D. Kw/c(H+)=10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中含有CN-和Cr2O![]() 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
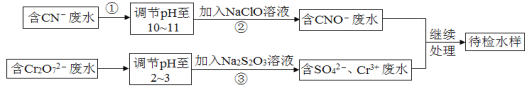
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为_______。
(2)步骤③的反应为![]() (未配平),则每反应0.1molCr2O72-时,消耗S2O32-_____mol。
(未配平),则每反应0.1molCr2O72-时,消耗S2O32-_____mol。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是______。
(4)在25℃下,将![]() 的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a____0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____。
的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a____0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程式是_______;________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是 ( )
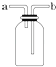
A.洗气或干燥装置:瓶内放一定体积溶液,由a管口进气
B.用于收集难溶于水的气体:瓶内充满水,由b管口进气
C.提供少量CO:瓶内充满CO,b管口接自来水龙头
D.H2S和SO2反应的装置:由a管口通入H2S,b管口通入SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
芳香族化合物A(![]() )是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如图所示:
)是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如图所示:
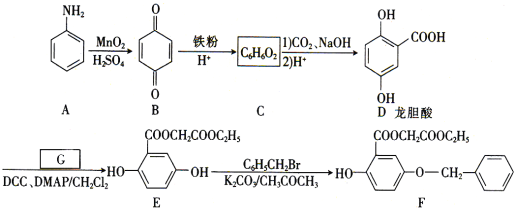
(1)A的分子式是______,B中含有的官能团的名称是_________。
(2)D→E的反应类型是_______。
(3)已知G能与金属钠反应,则G的结构简式为_________。
(4)写出E→F的化学方程式:_________。
(5)写出符合下列条件的龙胆酸乙酯(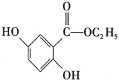 )的同分异构体有______种,写出其中一种同分异构体的结构简式:_________________ 。
)的同分异构体有______种,写出其中一种同分异构体的结构简式:_________________ 。
①能发生银镜反应,与FeCl3溶液不发生显色反应,但水解产物之一能与FeCl3溶液发生显色反应;②核磁共振氢谱有四组峰,且峰的面积之比为6:2:1:1。
(6)已知: 。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(
。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(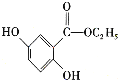 )的合成路线(无机试剂任用):________。
)的合成路线(无机试剂任用):________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同系物和同分异构体的判断正确的是( )
A. C5H12有4种同分异构体
B. ![]() 还有4种含有苯环的同分异构体
还有4种含有苯环的同分异构体
C. C9H20与C2H6一定互为同系物关系
D. C4H8与C2H4一定互为同系物关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. Ksp(CuS)<Ksp[Cu(OH)2]
C. 升高温度![]() 增大
增大
D. 加入MgCl2固体,HS-浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化铈[Ce(OH)4]是一种重要的稀土氢氧化物。平板电视显示屏生产过程中会产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2),某课题组以此粉末为原料回收铈,设计实验流程如下:
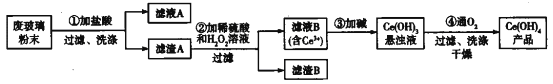
下列说法错误的是
A. 滤渣A中主要含有SiO2、CeO2
B. 过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒
C. 过程②中发生反应的离子方程式为CeO2+H2O2+3H+=Ce3++2H2O+O2↑
D. 过程④中消耗 11.2L O2(已折合成标准状况),转移电子数为2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X位于第四周期,其基态原子有4个未成对电子。Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子。
(1)Y与Z可形成多种化合物。
① 元素Y与Z中电负性较大的是________(用元素符号描述)。
② 离子ZY32-的空间构型为________(用文字描述)。
③ 写出一种与ZY2互为等电子体的分子的化学式:________。
(2)Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是________。
(3)含X2+的溶液与KCN、氨水反应可得到化合物K3[X(CN)5(NH3)]。1 mol配合物K3[X(CN)5(NH3)]中含σ键的数目为______。
(4)下图为X与Z所形成的一种化合物的基本结构单元,推测该化合物的化学式为______。
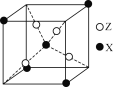
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com