
【题目】如下图所示,△H1=-393.5kJ.mol-1, △H2=-395.4kJ.mol-1,下列正确的是

A. C(s、石墨)="=" C(s、金刚石) △H=" +1.9" kJ·mol -1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学利用下图所示实验装置进行实验.
(1)气体发生装置中反应的化学方程式是 。
(2)实验室常用排饱和食盐水的方法来收集 Cl2,试用化学平衡原理加以解释 .
以下甲学生对 Cl2 与 FeCl2 和 KSCN 混合溶液的反应进行实验探究。
(3)A 中溶液变红的原因是 。
(4)为了探究现象 II 的原因,甲同学进行如下实验。
①取 A 中黄色溶液于试管中,加入 NaOH 溶液,有红褐色沉淀生成,则溶液中一定存在 。
②取 A 中黄色溶液于试管中,加入过量的 KSCN 溶液,最终得到红色溶液。
甲同学的实验证明产生现象Ⅱ的原因是 SCN-与 Cl2发生了反应。
(5)甲同学猜想 SCN-可能被 Cl2氧化了,他又进行了如下研究。
资料显示:SCN-的电子式为![]()
①甲同学认为 SCN-中碳元素没有被氧化,理由是 。
②取A中黄色溶液于试管中,加入用盐酸酸化的 BaCl2 溶液,产生白色沉淀,由此证明 SCN-中被氧化的元素是 (填名称)。
③通过实验证明了 SCN-中氮元素转化为NO3-,他的实验方案是 。
④若 SCN-与Cl2反应生成CO2,写出反应离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于水玻璃的性质和用途的叙述中不正确的是( )
A.这是一种矿物胶,既不燃烧也不受腐蚀
B.在建筑工业上可以作黏合剂、耐酸水泥掺料
C.木材、织物浸过 水玻璃后具有防腐性能且不易燃烧
D.水玻璃的化学性质稳定,在空气中不易变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:

(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ag铁粉与含有H2SO4的CuSO4溶液恰好完全反应后,得到ag铜,则参与反应的CuSO4与H2SO4的物质的量之比为
A.5∶2
B.7∶1
C.3∶8
D.8∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]某研究小组以烃A为主要原料,采用以下路线合成药物X和高聚物Y:

已知:![]()
![]()
 (R或R'可以是烃基或H原子)。
(R或R'可以是烃基或H原子)。
请回答下列问题:
(1)X的分子式为_____________,X中的含氧官能团有____________。
(2)E的结构简式为____________________,反应③的条件是_____________________,反应⑤的反应类型是________________
(3)写出反应④的化学方程式:__________________________。
(4)写出同时符合下列条件的E的一种同分异构体的结构简式:________________
①属于酚类化合物,且是苯的对位二元取代物;②能发生银镜反应和水解反应。
(5)以CH3CHO为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。
合成路线的书写格式参照如下示例流程图:CH3CH2OH![]()
![]()
![]() BrH2C—CH2Br
BrH2C—CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]X、Y、Z、W是前四周期中常见的四种元素。X的基态原子核外电子共占据5个原子轨道,其中能量最高的能级上的电子有3种运动状态;Y能形成最强的无机含氧酸,Z的单质是前36号元素中最活泼的金属单质,W的一种核素的质量数是56,中子数是30。
(1)W的稳定价态离子的核外电子排布式为_________,Y、Z、W电负性由大到小的顺序为___________(填元素符号)。
(2)X与同周期相邻的另外两种元素相比其第一电离能最大,原因是_____________________X和与X同族的另外两种前四周期元素的简单氢化物的沸点由低到高的顺序为_______________,试解释其原因__________________
(3)XY3的中心原子轨道杂化类型为_________
(4)已知WY3的沸点为319 ℃,熔点为306 ℃,则WY3的晶体类型为____________Z的重要化合物Z2O2中存在的化学键类型有_______________
A.离子键 B.极性共价键 C.非极性共价键 D.π 键
(5)若Z的晶胞为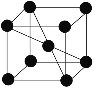 ,Z离子的半径为d cm,则Z单质的密度为_______。
,Z离子的半径为d cm,则Z单质的密度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物和含碳化合物的转化对环境保护具有重要意义。
(1)SO2的大量排放会引起严重的环境问题是 ,潮湿条件下,写出大气中SO2转化为HSO3-的方程式 ;
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:

1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 ;
(3)SO2是工业制硫酸的原料之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g),过程中测定的部分数据见下表:
2SO3(g),过程中测定的部分数据见下表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.05 |
4 | 0.04 | 0.02 |
6 | 0.02 | |
8 | 0.01 |
①反应在0-4min内的平均速率为v(SO2)= ;
②此温度下该反应的化学平衡常数K= ;
③8min时,维持温度不变,向反应容器中再通入0.02mol SO2(g)和0.01mol O2(g),重新达到平衡时混合气体中SO2的百分含量将 (填“减小”、“增大”或“不变”)。
(4)科学家用氮化镓材料与铜组装如下图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4的反应。

写出铜电极表面的电极反应式 ,为提高该人工光合系统的工作效率,可向装置中加入少量 (填“盐酸”或“硫酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol·L-1、体积均为V0的MOH和ROH分别加水稀释至体积V,pH随lg![]() 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
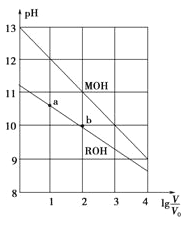
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则 ![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com