
| A. | NaNO3 | B. | NaOH | C. | HCl | D. | NaCl |
分析 用石墨作电极,电解下列物质的溶液,通电一段时间后溶液的pH不变,说明该电解质溶液中氢离子或氢氧根离子浓度不变,则溶液中的电解质不能是酸、碱、氢之后的含氧酸盐或氢之前的氯化物、溴化物或碘化物等,以此解答该题.
解答 解:A.电解NaNO3溶液时,阳极上氢氧根离子放电、阴极上氢离子放电,相当于电解水,溶液中的溶质是强酸强碱盐,所以溶液pH不变,故A正确;
B.电解氢氧化钠,溶液中氢离子、氢氧根离子放电,相当于电解水,导致溶液中氢氧化钠的浓度增大,溶液的pH值增大,故B错误;
C.电解氯化氢溶液时,阳极上氯离子放电、阴极上氢离子放电,导致溶液中氢离子浓度减小,溶液的pH增大,故B错误;
D.电解氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,导致溶液中氢氧根离子浓度增大,溶液的pH变大,故D错误.
故选A.
点评 本题以电解原理为载体考查了电解质溶液中离子的放电顺序,为高频考点,侧重考查学的分析能力,电解电解质溶液时,有电解水型,如电解硫酸钠溶液;有电解电解质型,如电解氯化铜溶液;有电解电解质和水型,如电解氯化钠溶液.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | Ca2+ | C. | I- | D. | SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
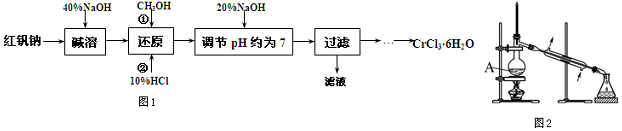
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NH4+、Cl+ | B. | Mg2+、Ba2+、Br- | C. | Mg2+、Cl-、Fe2+ | D. | K+、SiO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 混合气体的密度 | C. | C与D的浓度比 | D. | 气体总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g铁片投入足量浓H2SO4中,转移电子数目为0.3 NA | |
| B. | MnO2与浓盐酸共热,0.4 molHCl被氧化时,转移电子数目为0.4 NA | |
| C. | 高温下,0.3 molFe与足量水蒸气反应,转移电子数目为0.8NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
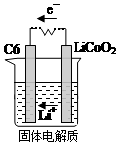 某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )
某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )| A. | 阴极 | B. | 阳极 | C. | 负极 | D. | 正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com