
(8分)某小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
(2)滴定时用 (填a或b)滴定管盛装KMnO4标准溶液。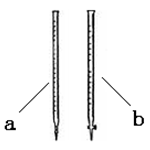
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)某小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
(2)滴定时用 (填a或b)滴定管盛装KMnO4标准溶液。
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2013届度辽宁省高二下学期开学初考试化学试卷 题型:实验题
(8分)某小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
(1)滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
(2)滴定时用 (填a或b)滴定管盛装KMnO4标准溶液。

(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com