
【题目】已知:常阻下,Ksp.(ZnS)=1.6×10—24;pM=—lgc(M2+)(MI2+为Cu2+或Zn2+)。常温下,向10 mL 0.10 mol/L CuCl2溶液中滴加0.10 mol/L Na2S溶液,滴加过程中pM与Na2S溶液体积(V)的关系如图所示。下列说法错误的是( )
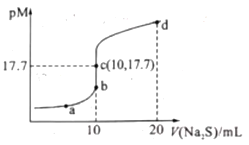
A.Ksp(CuS)的数量级为10-36
B.a点溶液中,c(Na+)=2[c(S2—)+c(HS—)+c(H2S)]
C.d点溶液中:c(Na+)>c(Cl—)>c(S2—)>c(H+)
D.相同条件下,若用等浓度等体积的ZnCl2溶液代替上述CuCl2溶液,则反应终点c向b方向移动
【答案】B
【解析】
向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,结合图象计算溶度积常数和溶液中有关守恒分析解答此题。
A.该温度下,平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,则Ksp(CuS)=c(Cu2+)·c(S2-)=10-17.7mol/L×10-17.7mol/L=10-35.4=100.6×10-36,由于1<100.6<10,则Ksp(CuS)的数量级为10-36,故A正确;
B.a点溶液中所含有的溶质为NaCl和Na2S,则根据物料守恒可知,c(Na+)=2[c(S2—)+c(HS—)+c(H2S)]+c(Cl—),故B错误;
C.d点时溶质为NaCl和Na2S,n(Na+)=0.1mol/L×0.02L×2=0.004mol,n(Cl-)=0.1mol/L×0.01L×2=0.002mol,即c(Na+)>c(Cl-),Na2S是弱酸强碱盐,水解使溶液显碱性,即c(S2-)>c(OH-)>c(H+),所以c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+),故C正确;
D.已知Ksp(CuS)=10-35.4、Ksp(ZnS)=1.6×10—24,则若用等浓度等体积的ZnCl2溶液代替上述CuCl2溶液,滴加Na2S溶液10mL时恰好完全反应,此时溶液中c(Zn2+)>c(Cu2+),即PM(Cu2+)>PMc(Zn2+),反应终点c向b方向移动,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,G为电流计。有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小、b极质量增加 | 溶液中的SO42-向b极移动 | d极溶解c极有气体产生 | 电子从d极流向a极 |
由此可判断这四种金属的活动性顺序是
A. d>a>b>cB. a>b>c>dC. b>c>d>aD. a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结构的研究是有机化学最重要的研究领域.某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式如下:(其中Ⅰ、Ⅱ为未知部分的结构).

为推测X的分子结构,进行如图转化:

已知向D的水溶液中滴入FeCl3溶液显紫色,对D的结构进行光谱分析,在氢核磁共振谱上显示只有两种信号.M、N互为同分异构体,M中含有一个六原子环,N能使溴的四氯化碳溶液褪色,G能与NaHCO3溶液反应.请回答:
(1)G分子所含官能团的名称是__;
(2)D不可以发生的反应有(选填序号)__;
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)写出上图转化中反应①和②的化学方程式
①B+F→M__;
②G→N__;
(4)已知向X中加入FeCl3溶液,能发生显色反应,则X的结构简式是:___________,1mol该 X与足量的NaOH溶液作用,最多可消耗NaOH__mol;
(5)有一种化工产品的中间体W与G互为同分异构体,W的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基.则W的分子结构有__种,写出任意一种的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2L甲烷、乙烷、甲醛组成的混合气体,完全燃烧后生成15.68L CO2(气体体积均在标准状况下测定),混合气体中乙烷的体积百分含量为( )
A.80%B.60%C.40%D.20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成两者溶液的体积之和),下列说法正确的是( )
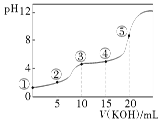
A.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
B.点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1
D.点⑤所示溶液中:c(OH-)= c(H+)+ c(HC2O4-)+ c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同浓度的两种一元酸HX、HY分别用同一浓度的NaOH标准溶液滴定,滴定曲线如图所示。下列说法正确的是![]()
![]()
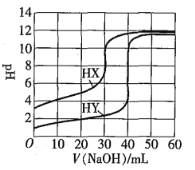
A.HX、HY起始溶液体积相同
B.均可用甲基橙作滴定指示剂
C.pH相同的两种酸溶液中:![]()
D.同浓度KX与HX的混合溶液中,粒子浓度间存在关系式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
B.将水加热,KW增大,pH不变
C.向水中加入氨水,平衡逆向移动,c(OH-)降低
D.向水中加入固体醋酸钠,平衡逆向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L1nol/L某一元酸HR溶液中滴加一元碱BOH溶液,混合溶液的![]() 与pH变化的关系如图所示.下列叙述正确的是
与pH变化的关系如图所示.下列叙述正确的是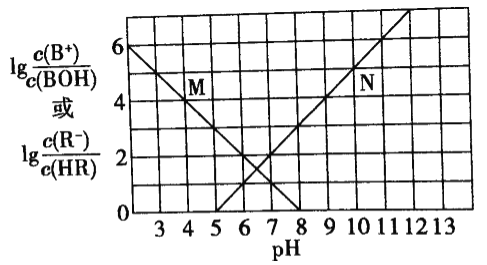
A. M线表示![]() 随pH的变化B. BR溶液呈碱性
随pH的变化B. BR溶液呈碱性
C. 若温度升高,两条线均向上平移D. 常温下,0.1mol·L-1NaR溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
A. x=4 B. 2 min内B的反应速率为0.1 mol·(L·min)-1
C. 混合气体密度不变,则表明该反应已达到平衡状态 D. B的转化率为40%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com