
标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6g硫化氢④0.2mol NH3.下列对这四种气体的关系从小到大表示不正确的是()
| A. | 体积:④<①<②<③ | B. | 密度:①<④<③<② | |
| C. | 质量:④<①<③<② | D. | 氢原子数:②<④<③<① |
| 阿伏加德罗定律及推论. | |
| 分析: | 标况下,气体摩尔体积相等,甲烷的物质的量= n(H2S)= A.根据V=nVm知,其体积大小与物质的量成正比; B.根据ρ= C.根据m=nM计算其质量; D.根据N=nNA计算其分子个数,再结合分子构成计算H原子个数. |
| 解答: | 解:标况下,气体摩尔体积相等,甲烷的物质的量= A.根据V=nVm知,其体积大小与物质的量成正比,所以其体积从小到大顺序是:④<①<③<②,故A错误; B.根据ρ= C.甲烷质量=16g/mol×0.3mol=4.8g,硫化氢质量为13.6g,HCl质量=0.5mol×36.5g/mol=18.25g,氨气质量=0.2mol×17g/mol=3.4g,所以其质量顺序为:④<①<③<②,故C正确; D.根据N=nNA知,其分子个数之比等于其物质的量之比,甲烷中H原子个数为1.2NA,HCl中H原子个数为0.5NA,硫化氢中H原子个数为0.8NA, 故选A. |
| 点评: | 本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量的关系是解本题关键,熟练掌握物质的量有关公式,题目难度不大. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列有关化学反应速率的说法正确的是( )
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100 mL 2 mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学按下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水,当K闭合时,SO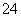 从右向左通过交换膜移向A极。下列分析正确的是( )
从右向左通过交换膜移向A极。下列分析正确的是( )
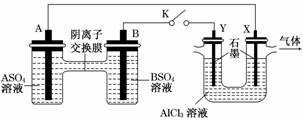
A.溶液中c(A2+)减小
B.B极的电极反应:B-2e-===B2+
C.Y电极上有H2产生,发生还原反应
D.反应初期,X电极周围出现白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使得甲醚在制药、燃料、农药等化学工业中有许多独特的用途。
(1)已知:2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol·L-1) | 0.8 | 1.24 | ? |
①平衡时,c(CH3OCH3)等于________ mol·L-1,反应混合物的总能量减少________ kJ。
②若在平衡后的容器中再加入与起始时等量的CH3OH,请在下图中画出CH3OH的转化率和浓度的曲线示意图。

(2)在直接以甲醚为燃料的电池中,电解质溶液为酸性,负极的反应为________________、正极的反应为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱工业电解所用的氯化钠溶液需精制。除去有影响的Ca2+、Mg2+、NH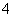 、SO
、SO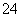 及泥沙,其精制流程如下:
及泥沙,其精制流程如下:
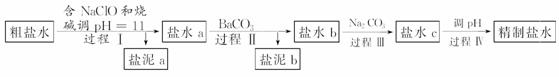 已知:①Ca2+、Mg2+开始形成相应氢氧化物沉淀的pH如下表。
已知:①Ca2+、Mg2+开始形成相应氢氧化物沉淀的pH如下表。
| Ca(OH)2 | Mg(OH)2 | |
| pH | ≥11.5 | ≥4.2 |
②Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9,Ksp(CaCO3)=5.0×10-9。
下列说法正确的是( )
A.盐泥a除泥沙外,还含有Ca(OH)2和Mg(OH)2
B.过程Ⅰ中将NH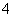 转化为N2的离子方程式是3ClO-+2NH
转化为N2的离子方程式是3ClO-+2NH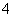 ===3Cl-+N2↑+3H2O+2H+
===3Cl-+N2↑+3H2O+2H+
C.过程Ⅱ中通入CO2有利于除SO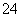
D.过程Ⅳ调pH可以使用硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两种化合物都只含X、Y两种元素,甲、乙中X元素的百分含量分别为30.4%和25.9%.若已知甲的分子式是XY2,则乙的分子式只可能是()
| A. | XY | B. | X2Y | C. | X2Y3 | D. | X2Y5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
若以ω1和ω2分别表示浓度为amol•L﹣1和bmol•L﹣1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)()
| A. | 2ω1=ω2 | B. | 2ω2=ω1 | C. | ω2>2ω1 | D. | ω1<ω2<2ω1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车为期中含有氮的氧化物,它是城市空气的污染源之一.汽车行驶时,由于点火化的作用,在汽缸里发生了一系列的化学反应,其中有N2+O2 2NO;2NO+O2=2NO2;这两个反应都属于()
2NO;2NO+O2=2NO2;这两个反应都属于()
| A. | 分解反应 | B. | 置换反应 | C. | 化合反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
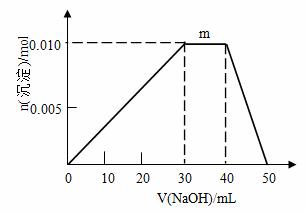
①R离子浓度由大到小的顺序是:__________。
②写出m点反应的离子方程式_________________。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com