
甲、乙分别是由同主族元素R、Z组成的两种单质,常温下能进行如下反应:甲+乙+H2O→HRO3+HZ(未配平)。下列说法不正确的是
A.制备1mol R转移电子数一定为2NA
B.R、Z简单离子的还原性:Z(离子)﹤R(离子)
C.HZ分子的稳定性大于HR分子
D.HRO3与HZ计量数之比为1:5
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:填空题
有机物A为烃类化合物,相对分子质量为70,其相关反应如下图所示,其中B、D、E的结构中均含有2个—CH3 ,且它们均含有4种等效H。

已知:1)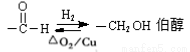 2)
2)
请回答:
(1)B中所含官能团的名称为__________;
(2)Ⅱ、Ⅲ的反应类型依次为为 __________(填字母序号);
a.取代反应 b.加成反应 c.氧化反应 d.消去反应
(3)写出下列反应的化学方程式:
a.反应Ⅰ:________________________________________
b.A 在催化剂条件下,反应生成高聚物:________________________________________
(4)A 的系统命名为____________________,A 的同分异构体中有一对互为顺反异构的链状有机物,且结构中含有2个—CH3,其顺式异构体的结构简式为__________
(5)C的某同分异构体F可以催化氧化,但不能发生消去反应,F的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三下最后一次模拟理综化学试卷(解析版) 题型:实验题
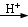
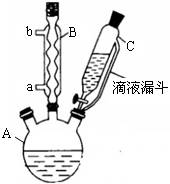
(14 分) 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应、装置图如下:
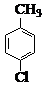
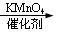
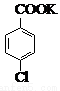 +MnO2
+MnO2 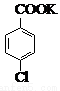
常温条件下的有关数据如下表所示:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 颜色 | 水溶性 | |
对氯甲苯 | 126.5 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
对氯苯甲酸 | 156.5 | 243 | 275 | 1.54 | 白色 | 微溶 |
对氯苯甲酸钾 | 194.5 | 具有盐的通性,属于可溶性盐 | ||||
实验步骤:在规格为250mL的装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g。
请回答下列问题:
(1)装置B的名称是 。
(2)量取6.00mL对氯甲苯应选用的仪器是 。(填选仪器序号)
A.10mL量筒 B.50mL容量瓶 C.50mL酸式滴定管 D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是 。对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是 。
(4)第一次过滤的目的是 ,滤液中加入稀硫酸酸化,可观察到的实验现象是 。
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是 。
(6)本实验的产率是 (填标号)。A.60% B.70% C.80% D.90%
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三第七次模拟理综化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的值,下列叙述正确的是
A.1mol Na2O2与足量的水反应,转移的电子数为2NA
B.17g羟基中含有的电子数为10NA
C.标准状况下,1mol已烷中共价键数目为19NA
D.1L 0.10mol·L-1的Na2CO3溶液中阴离子数目之和小于0.1NA
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下学期冲刺模拟理综化学A卷(解析版) 题型:填空题
为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)等的排放量。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H2=-586.7kJ/mol
(1)若用4.48LCH4还原NO生成N2,则放出的热量为______kJ。(气体体积已折算为标准状况下)
Ⅱ.(2)NOx可用强碱溶液吸收产生硝酸盐。在酸性条件下,FeSO4溶液能将NO3-还原为NO,NO能与多余的FeSO4溶液作用生成棕色物质,这是检验NO3-的特征反应。写出该过程中产生NO的离子方程式: 。
(3)用电化学处理含NO3-的废水,电解的原理如图1所示。则电解时阴极的电极反应式为 ;当电路中转移20 mol电子时,交换膜左侧溶液质量减少________g。
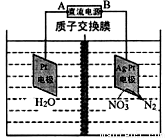
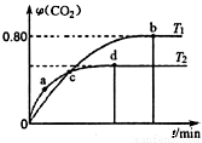
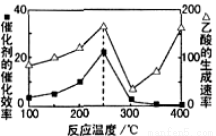
图1 图2 图3
Ⅲ.利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s) 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 molCO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
(4)T1时,该反应的化学平衡常数的数值为 。
(5)下列说法不正确的是_______(填字母)。
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,在原容器中充入一定量氦气,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
Ⅳ.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g)
CH3COOH(g) △H<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。
(6)①250~300℃时,乙酸的生成速率减小的主要原因是 。
②工业生产中该反应的温度常选择250℃、不选择400℃,从综合经济效益考虑,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:实验题
下图为工业合成氨生产简易流程图:

回答下列问题:
(1)合成氨所需的氮气来源于__________;合成氨所需的原料气氢气可由天然气制备,其主要反应为CH4(g)+H2O(g)=CO(g)+3H2(g);CH4和O2的反应:2CH4(g)+O2(g)=2CO(g)+4H2(g).CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气中氧气含量不同)混合反应,产物气体组成如下表:
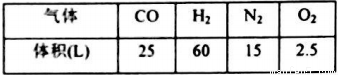
计算该富氧空气中O2和N2的体积比V(O2):V(N2)=__________。
(2)在合成氨的原料气中混有的杂质必须除去的原因是__________;
上述流程中热交换器的作用是__________。从合成塔出来的混合气体,通常仅含有15%(体积分数)的氨。为提高原料的利用率,通常采取的措施是__________。
(3)合成氮为放热反应,但工业上采用400℃-500℃的温度,主要原因是:
①该温度范围内反应速率较快,②__________。
(4)氨可与CO2反应制备尿素(CO(NH2)2],反应过程分为两步,试写出有关的化学方程式:
①氮气与二氧化碳在加热加压条件下化合生成氨基甲酸铵(H2NCOONH4):__________。
②氨基甲酸铵受热分解为尿素与水:__________。
(5)新法合成氨常采用电解法合成。即常压下将氢气和用氢气稀释的氮气分别通入一个加热到570℃的电解池中,氢气和氮气在电极上合成了氨,大大提高了氨的产率,新法合成氨所用的电解质能传导H+,则阴极的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:填空题
己知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
N2(g)+3H2(g)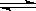 2NH3(g)△H=-92.60kJ/mol
2NH3(g)△H=-92.60kJ/mol

根据表中数据回答:
(1)反应进行到20min时放出的热量为__________kJ。
(2)0-10min内的平均反应速率v(N2)为__________mol/(L·min)
(3)此温度下该逆反应的化学平衡常数K(逆)=__________(保留两位小数).
(4)反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将__________(填“正向移动”或“逆向移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三5月高考模拟理综化学试卷(解析版) 题型:填空题
一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1
CO(g)+H2O(g) ΔH1
反应2:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应3:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图l所示。反应1、3的活化能如图2所示。

(1)则ΔH2________ΔH3(填“大于”、“小于”或“等于”),理由是________。
(2)反应1中ΔS1______0(填>、=或<=),指出有利于自发进行的温度条件____(填“较高温度”或:“较低温度”)
(3)将体积比为1:1的H2和CO2充入容积可变密闭容器内,若只进行反应1,下列措施中能使平衡时 增大的是____________(填序号)
增大的是____________(填序号)
A.升高温度B.增大压强C.充入一定量的CO2 D.再加入一定量铁粉
(4)为了提高CO2和H2制备甲醇生产效率和产量;工业生产中通常采取的措施是____________
(5)在温度为300℃时,使-定量合适体积比为的H2和CO2在体积恒定的密闭容器内进行反应。该温度下反应2进行程度很小可看成不进行,请在图3中画出CO、CH3OH浓度随时间变化至平衡的定性曲线图。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附中高一下期中化学试卷(解析版) 题型:选择题
已知三价铁离子的氧化性比铜离子强。现将amol铁和bmol铜的混合物与含有cmolHNO3的稀溶液充分反应,设还原产物为NO。下列结论:①若只有一种氧化产物,则3c=8a;②若只有二种氧化产物,被还原的硝酸物质的量为0.25c mol;③若有三种氧化产物,被还原的硝酸物质的量为0.25c mol;④若剩余金属0.5a mol,则氧化产物为一种或二种。其中正确的组合是
A.只有② B.①② C.②③ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com