
 (1)铁、铝、铜是人类使用广泛的三种金属.
(1)铁、铝、铜是人类使用广泛的三种金属.| 原料 | 杂木屑 | 麦麸 | 生石灰(粉) | 过磷酸钙 |
| 质量(kg) | 200 | 50 | 2.5 | 5 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
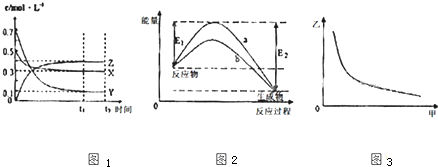
| A、该反应的化学方程式为X(g)+3Y(g)?2Z(g) |
| B、若图Ⅲ中甲表示压强,乙表示Z的含量,则其变化符合图Ⅲ中曲线 |
| C、该温度下,反应的平衡常数数值约为533.若升高温度,该反应的平衡常数减小,Y的转化率降低 |
| D、图II中曲线a、b可表示使用不同催化剂的能量变化曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
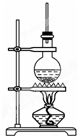 如图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:
如图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com