
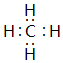 ,上述元素中,能和⑤号元素形成正四面体空间网状结构的化合物的化学式是SiO2.
,上述元素中,能和⑤号元素形成正四面体空间网状结构的化合物的化学式是SiO2.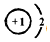 、
、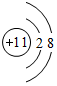 .
. 分析 由元素在周期表中的位置可知:①为H,②为Na,③为C,④为N,⑤为O,⑥为Si.
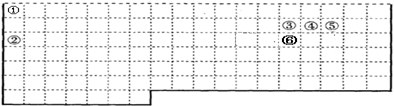
(1)第一周期含有2种元素,分别处于第1列、第18列,第二、第三周期中3~12列没有元素;
(2)①、③两种元素组成的正四面体化合物为CH4,上述元素中,能和⑤号元素形成正四面体空间网状结构的化合物二氧化硅;
(3)上述元素中的一种元素其气态氢化物和该元素的最高价氧化物的水化物能发生化合反应,该反应的产物是硝酸铵;
(4)①和②元素在适当条件下能形成离子化合物为NaH.
解答 解:由元素在周期表中的位置可知:①为H,②为Na,③为C,④为N,⑤为O,⑥为Si.
(1)第一周期含有2种元素,分别处于第1列、第18列,第二、第三周期中3~12列没有元素,补全元素周期表边界为: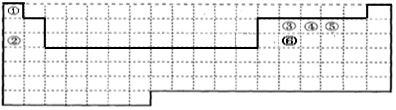 ,
,
故答案为: ;
;
(2)①、③两种元素组成的正四面体化合物为CH4,其电子式为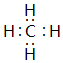 ,上述元素中,能和⑤号元素形成正四面体空间网状结构的化合物二氧化硅,
,上述元素中,能和⑤号元素形成正四面体空间网状结构的化合物二氧化硅,
故答案为: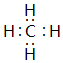 ;SiO2;
;SiO2;
(3)上述元素中的一种元素其气态氢化物和该元素的最高价氧化物的水化物能发生化合反应,该反应的产物是NH4NO3,含有离子键、共价键,
故答案为:NH4NO3;离子键、共价键;
(4)①和②元素在适当条件下能形成离子化合物为NaH,H-离子结构示意图为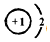 ,Na+离子结构示意图为
,Na+离子结构示意图为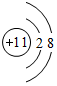 ,
,
故答案为: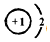 、
、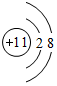 .
.
点评 本题考查元素周期表、常用化学用语、元素化合物知识,识记中学常见物质结构特点,金属氢化物在中学基本不涉及,但在试题中经常考查,需要学生注意理解掌握.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③⑥ | C. | ③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 火力发电厂的煤经粉碎、脱硫处理 | B. | 电镀废液经中和后直接排入到农田 | ||
| C. | 聚乳酸塑料代替传统塑料作购物袋 | D. | 回收并合理处理聚氯乙烯塑料废物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阿伏加德罗常数是12 g碳中所含的碳原子数 | |
| B. | 24 g镁的原子最外层电子数为NA | |
| C. | 阿伏加德罗常数约是6.02×1023 | |
| D. | 阿伏加德罗常数的符号为NA,近似为6.02×1023 mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -Y kJ/mol | B. | -(5X-0.5Y)kJ/mol | C. | -(10X-Y)kJ/mol | D. | +(10X-Y)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 中和时所需NaOH的量 | B. | 电离的程度 | ||
| C. | H+的物质的量浓度 | D. | H+的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
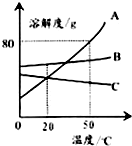
| A. | 50℃时A物质的溶解度最大 | |
| B. | 升温可使C物质的不饱和溶液变成饱和溶液 | |
| C. | 50℃时把90gA物质放入100g水中能得到190g溶液 | |
| D. | 将50℃三种物质的饱和溶液分别降温到20℃时,B溶液溶质质量分数最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
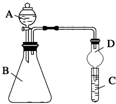 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com