
| A. | 含X与Y的化合物只有2种 | |
| B. | Y、W的氧化物均为酸性氧化物 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X与Z形成的化合物中,各原子均满足8电子稳定结构 |
分析 短周期主族元素X、Y、Z、W的原子序数依次递增,X的一种原子核内无中子,则X为H元素;Y原子最外层电子数是内层电子总数的2倍,原子只能有2个电子层,最外层电子数为4,故Y为C元素;W原子最外层电子数是Y原子最外层电子数的1.5倍,W原子最外层电子数为6,Z、W同主族,则Z为O元素、W为S元素.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次递增,X的一种原子核内无中子,则X为H元素;Y原子最外层电子数是内层电子总数的2倍,原子只能有2个电子层,最外层电子数为4,故Y为C元素;W原子最外层电子数是Y原子最外层电子数的1.5倍,W原子最外层电子数为6,Z、W同主族,则Z为O元素、W为S元素.
A.含X与Y的化合物为烃类物质,种类繁多,故A错误;
B.CO不属于酸性氧化物,是不成盐的氧化物,故B错误;
C.碳酸属于弱酸,而硫酸属于强酸,故C正确;
D.X与Z形成的化合物中H原子一定不满足8电子稳定结构,故D错误,
故选:C.
点评 本题考查位置结构性质关系应用,关键是根据原子结构推断推断元素,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③④ | C. | ②⑤⑥ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不仅有第2列元素的原子最外层有2个电子 | |
| B. | 第3~12列元素全为金属 | |
| C. | 第3列元素种类最多 | |
| D. | 第15、16、17列元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
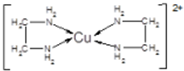
 ,其中Cl-的配位数为4,已知晶胞的棱长为dcm,用NA表示阿伏加德罗常数值,则晶胞的密度表达式为$\frac{396}{{d}^{3}•{N}_{A}}$g/cm3.
,其中Cl-的配位数为4,已知晶胞的棱长为dcm,用NA表示阿伏加德罗常数值,则晶胞的密度表达式为$\frac{396}{{d}^{3}•{N}_{A}}$g/cm3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱NaOH,食盐NaCl | B. | 小苏打Na2CO3,苛性钠NaOH | ||
| C. | 苏打NaHCO3,石灰石CaCO3 | D. | 芒硝Na2SO4•10H2O,消石灰Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ,G中化学键的类型为极性共价键;
,G中化学键的类型为极性共价键;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③④ | C. | ①②③④ | D. | ①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com